
【题目】主族元素在周期表的位置,取决于元素原子的( )
A. 中子数
B. 相对原子质量
C. 电子层数和最外层电子数
D. 次外层电子数
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池——锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法不正确的是( )
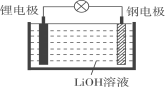
A. 锂为负极,钢为正极B. 工作时负极的电极反应式为Li-e-=Li+
C. 工作时OH-向钢电极移动D. 放电时电子的流向:锂电极→导线→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有机物M的合成路线如下图:
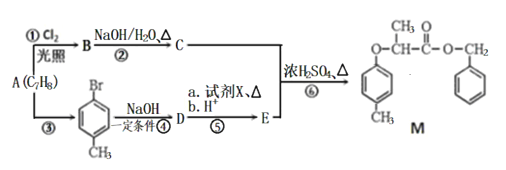
已知:i: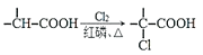 ii:
ii: 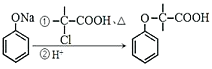
(1)M中含氧官能团的名称有醚键和___________,C的名称为___________,步骤⑥的反应类型为___________。
(2)步骤④反应的化学方程式为_________________________________。
(3)试剂X的结构简式为___________。
(4)同时满足下列条件,E的同分异构体有__________种。
I.能与FeCl3溶液发生显色反应;II.能发生水解反应和银镜反应;III.苯环上只有两个取代基。
其中核磁共振氢谱峰面积比为1:1:2:2:6的分子的结构简式为: ______________________。
(5)根据以上信息,写出以![]() 为原料制取
为原料制取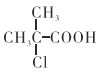 的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2
的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2所示装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
②_________________________________________________。
(2)能说明有SO2气体产生的实验现象是_________________________。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴人适量水中为试样,试样中所含金属离子的成分有以下三种可能:
I.只含有Fe3+;II.只含有Fe2+;III.既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀盐酸溶液 B.稀硫酸溶液 C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉—KI溶液 G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的____________(填试剂序号,下同),振荡,再滴加少量的___________,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤l 取试样,滴加少量的______________(填试剂序号),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________。
步骤2 再取适量的试样滴加少量的_______________________ (填试剂序号),溶液的颜色变为_____________,则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到化学平衡状态的标志是( )
2AB(g)达到化学平衡状态的标志是( )
A. 容器内A2、B2、AB三种气体的浓度相等
B. 单位时间内有a mol A2生成,同时就有amolB2消耗
C. 容器内气体的总质量不随时间变化而变化
D. 单位时间内有b molB2消耗,同时就有b molAB被分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它的制备方法如下图所示,下列说法正确的是
![]()
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 灼烧熔融的Na2CO3固体,可用石英坩埚
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点67.6℃),可通过蒸馏(或分馏)提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用图所示装置进行实验。
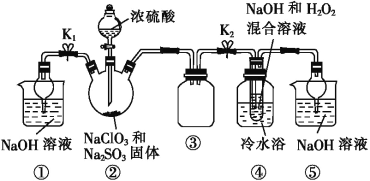
(1)装置①的作用是___________________,装置③的作用是________________。
(2)装置②中制备ClO2的化学方程式为___________________________;装置④中反应生成NaClO2的化学方程式为_____________________。
(3)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是取少量晶体溶于蒸馏水,__________________________________________________________。
(5)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,重复2次,平均消耗Na2S2O3溶液20.00 mL,计算得NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.溶液中一定不含Cu2+B.溶液中一定含Fe2+
C.加入KSCN溶液一定不变红色D.剩余固体中可能含有Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是
A.FeSO4(Fe)B.SnCl2(HCl)C.FeCl3(HCl)D.NaAlO2(NaOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com