
【题目】下列各元素的性质或原子结构递变规律错误的是
A. Li、Be、B原子最外层电子数依次增多
B. P、S、Cl元素的最高正价依次升高
C. Li、NA、K的金属性依次减弱
D. N、O、F原子半径依次减小
科目:高中化学 来源: 题型:
【题目】环戊二烯(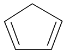 )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
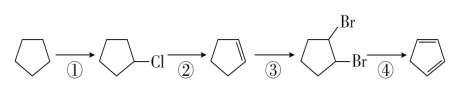
(1)其中,反应①的反应类型是______ ______,反应①的产物名称是____ ____;
反应②的反应类型是____ ____,反应②的产物名称是___ _____。
工业上可由环戊二烯制备金刚烷( ),途径如下:
),途径如下:

请回答下列问题:
(2)环戊二烯分子中最多有________个原子共平面;
(3)金刚烷的分子式为________,其分子中的二氯代物有________种;
(4)A是二聚环戊二烯的同分异构体,属于芳香烃,其苯环上的一氯代物只有二种,能使溴的四氯化碳溶液褪色。符合以上信息的A的所有可能结构(不考虑立体异构)有 种,试写出苯环上支链最多的几种同分异构体的结构简式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂可以区别MgCl2、FeCl2、AlCl3三种溶液,这种试剂是( )
A.AgNO3溶液 B.NAOH溶液 C.硫酸 D.KNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物X转化为Y或Z的能量变化如图所示。下列说法正确的是( )

A.由X→Y反应的△H=E5-E2
B.升高温度有利于提高Z的产率
C.由X→Y的反应,增加压强有利于提高X的转化率
D.由X→Z反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,固定体积的密闭容器内,反应2HI(g)![]() H2 (g)+ I2 (g)达到平衡状态的标志是:( )
H2 (g)+ I2 (g)达到平衡状态的标志是:( )
①I2的体积分数不再变化;
②生成1 mol H2同时消耗1 molI2;
③容器内压强不再变化;
④生成2 mol HI同时消耗1molH2;
⑤气体的密度不再变化;⑥混合气体的平均分子质量不再变化
A.①②③④⑤⑥ B.①②③⑤⑥ C.①②⑤⑥ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题满分18分)草酸亚铁为黄色固体,作为一种化工原料,可广泛用于涂料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:

(1)配制(NH4)2Fe(SO4)2![]() 6H2O溶液时,需加入少量稀硫酸,目的是_____________。
6H2O溶液时,需加入少量稀硫酸,目的是_____________。
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是_____________。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。

①则A-B发生反应的化学方程式为_____________;
②已知B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式_____________;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1mL。
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+,过滤。
Ⅳ.洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液。
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V2mL。
回答下列问题:
①已知:草酸(H2C2O4)与酸性高锰酸钾溶液反应,现象是有气泡产生,紫色消失,写出该反应的离子方程式:_____________;
②若省略步骤Ⅳ,则测定的草酸根离子含量(填“偏大”、“偏小”或“不变”)。
③m g样品中草酸根离子的物质的量为_____________(用c,V1,V2的式子表示,不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题满分18分)钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:

已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解.
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 ,操作2是 、过滤,副产品主要成分的化学式为 。
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理 。
(3)已知钛的还原性介于铝和锌之间,估计钛能耐腐蚀的原因之一是,如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式为 。
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++AlO3++3H2O,过过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000molL﹣1FeCl3溶液,发生Ti3++Fe3+═Ti4++Fe2+,当溶液出现红色达到滴定终点,用去了30.00mLFeCl3溶液,待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 6 mol·L-1的硫酸跟过量锌粒反应,在一定温度下,为了减慢反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠(固体) B.水 C.碳酸氢钠溶液 D.氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是( )

A.有机物A属于芳香烃
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.1mol A和足量的NaOH溶液反应,可以消耗3mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com