���仯�����ڻ�ѧ��ҵ��Ӧ�÷dz��㷺��
��1������β������Ҫ����CO��NO
2��SO
2��CO
2���壬����______�ܵ��¹⻯ѧ�������γɣ�
Ŀǰ���õ�������������װ���а�װһ����������������Ч�Ľ�β���е��к�����ת����
�磺CO��g��+NO
2��g��?NO��g��+CO
2��g����H=-akJ?mol
-1��a��0��
2CO��g��+2NO��g��?N
2��g��+2CO
2��g����H=-bkJ?mol
-1��b��0��
���ñ�״���µ�3.36L CO��ԭNO
2��N
2��CO��ȫ��Ӧ�������������зų�������Ϊ______kJ���ú���a��b�Ĵ���ʽ��ʾ����
��2����ҵ����������ʱ����SO
2����ΪSO
3�ǹؼ�һ����
��ij�¶��£���֪2SO
2��g��+O
2��g��?2SO
3��g������H=-196kJ?mol
-1����ʼʱ��10L���ܱ������м���4.0mol SO
2��g����5.0mol O
2��g����5���Ӻ�Ӧ�ﵽƽ�⣬���ų�����196kJ�����¶��´˷�Ӧ��ƽ�ⳣ��K=______����O
2��ʾ�ķ�Ӧ����Ϊ______��
��һ�������£���һ���������ܱ������г���2mol SO
2��1molO
2���������з�Ӧ��2SO
2��g��+O
2��g��?2SO
3��g�����ﵽƽ���ı�����������SO
2��O
2��SO
3����ƽ��Ũ�ȶ���ԭ���������______������ĸ����
A�������¶Ⱥ�����������䣬����2mol SO
3B�������¶Ⱥ�����������䣬����2mol N
2C�������¶Ⱥ�������ѹǿ���䣬����1mol SO
3D�������¶�
E���ƶ�����ѹ������
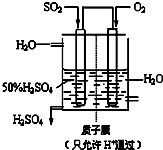
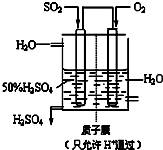
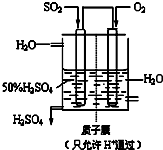
��3��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO
2�ĵ缫�ĵ缫��Ӧʽ______��