
【题目】在密闭容器中发生如下反应:mA(g)+nB(g)pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的 ![]() ,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
A.m+n>p
B.A的转化率降低
C.平衡向正反应方向移动
D.C的体积分数增加
【答案】B
【解析】解:平衡后将气体体积缩小到原来的 ![]() ,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动.
,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动.
A、增大压强平衡向逆反应方向移动,增大压强平衡向体积减小的方向移动,则有:m+n<p,故A错误;
B、增大压强平衡向逆反应方向移动,则反应物的转化率降低,故A的转化率降低,故B正确;
C、由上述分析可知,平衡向逆反应移动,故C错误;
D、平衡向逆反应移动,生成物的体积百分含量降低,即C的体积分数降低,故D错误.
故选B.
平衡后将气体体积缩小到原来的 ![]() ,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动,以此进行分析.
,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动,以此进行分析.
A、增大压强平衡向体积减小的方向移动;
B、增大压强平衡向逆反应方向移动,则反应物的转化率降低;
C、C的浓度为原来的1.9倍,不原来的2倍,故平衡向逆反应移动;
D、平衡向逆反应移动,生成物的体积百分含量降低.


科目:高中化学 来源: 题型:
【题目】不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
KW/10﹣14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因:
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为mol/L
③10℃时纯水的电离平衡常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中书写正确的是( )
A.NaHSO4Na++H++SO42﹣
B.NaHCO3Na++H++CO32﹣
C.HClO=H++ClO﹣
D.H2SH++HS﹣;HS﹣H++S2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( ) 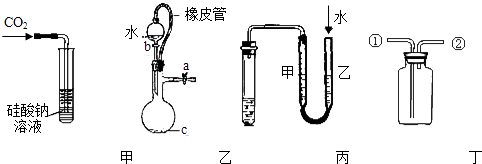
A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为我国产量最大的金属单质,根据图示的关系回答下列问题
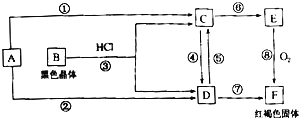
(1)写出化学式:B为 __________________,E为 _________________。
(2)反应 ①至⑧中,属于非氧化还原反应的是为 :_____________________(填序号)。
(3)反应③的离子方程式为 :________________________________________________________ 反应⑤的离子方程式为 :_________________________________________________________ 反应⑥的离子方程式为 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述不正确的是
A. 高温下,0.3molFe与足量水蒸气反应,转移电子数目为0.8NA
B. 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA
C. 在氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA
D. 在KClO3+6HCl(浓) ===KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸是在抗SARS病毒期间常使用的一种高效杀毒剂,其分子式为C2H4O3,它具有氧化漂白作用,下列物质中漂白原理与过氧乙酸不同的是( )
A. 氯水(次氯酸)B. 臭氧C. 二氧化硫D. 过氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(molL﹣1)随反应时间(min)的变化情况如下表:
时间 | 1 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为molL﹣1min﹣1
(2)实验2中,A的初始浓度c2=molL﹣1 , 反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的化学反应速率为v3 , 实验1的化学反应速率为v1 , 则v3v1(填“>”“=”或“<”),且c31.0molL﹣1(填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应的正反应是反应(填“吸热”或“放热”),理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com