
| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 2��10-11 |
|
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������Ӽ������й��ۼ� | B�����ۼ� |
| C�����Ӽ� | D����ѧ��δ�����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2O | B��Na2CO3��Һ | C��CaCl2��Һ | D���Ҵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
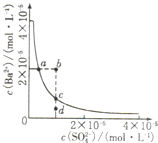
| A������Na2SO4��ʹ��Һ��a��䵽b�� |
| B��ͨ����������ʹ��Һ��d��䵽c�� |
| C��b����BaSO4�������� |
| D��a���Ӧ��Ksp����c���Ӧ��Ksp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| c(Br-) |
| c(Cl-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��MnS��Ksp��CuS��Ksp�� | ||
| B���÷�Ӧ�ﵽƽ��ʱc��Mn2+��=c��Cu2+�� | ||
| C����ƽ����ϵ�м�������CuSO4�����C��Mn2+����� | ||
D���÷�Ӧ��ƽ�ⳣ��K=
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Cd(OH)2 + 2Ni(OH)2����֪Ni(OH)2��Cd(OH)2��
Cd(OH)2 + 2Ni(OH)2����֪Ni(OH)2��Cd(OH)2��| A���ŵ�ʱ������Cd��2e����Cd2+ |
| B���ŵ�ʱ������2NiOOH + 2e�� + 2H2O��2Ni(OH)2 + 2OH�� |
| C�����ʱ������2Ni(OH)2��2e��+ 4H+��2Ni3+ + 4H2O |
| D�����ʱ������Cd(OH)2 + 2e����Cd + 2OH�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com