
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
分析 (1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Se;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,其中稀有气体的化学性质最不活泼;
(3)在这些元素的最高价氧化和对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3,二者发生中和反应;
(4)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(5)同周期自左而右金属性减弱,利用金属单质与水反应的剧烈程度或最高价氧化物对应水化物的碱性强弱证明.
解答 解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Se,
故答案为:N;Si;S;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,其中稀有气体的化学性质最不活泼,故在①-⑫元素中,最活泼的金属元素是K,最活泼的非金属元素是F,
故答案为:K;F;
(3)在这些元素的最高价氧化和对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3,二者发生中和反应,反应方程式为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O,
故答案为:HClO4;Al(OH)3;3HClO4+Al(OH)3=Al(ClO4)3+3H2O;
(4)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径最小为F,
故答案为:F;
(5)同周期自左而右金属性减弱,故活泼性Na>Mg,可以用它们跟水反应的实验证明:钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2,
故答案为:Na;钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2.
点评 本题考查元素周期表和元素周期律综合应用,熟练掌握元素周期表结构,注意金属性与非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:解答题
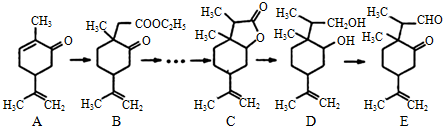
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
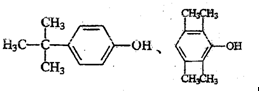
 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 | |
| C. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH4$\frac{\underline{\;高温\;}}{\;}$C+2H2 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,是制备半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明硅酸酸性强于碳酸 | |
| D. | Na2SiO3溶液中逐滴加入盐酸可制备硅酸胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1/L KAl(SO4)2溶液中含有Al3+离子数为0.1NA | |
| B. | 标准状况下,11.2L氦气含有分子数0.5NA | |
| C. | 1mol乙烷分子中含有7NA个共价键 | |
| D. | 32g硫与足量的铜反应,转移电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
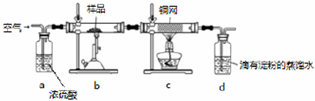
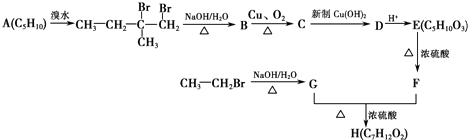
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数是NA | |
| B. | 常温常压下,NA个CO2占有的体积为22.4L | |
| C. | 1.06克Na2CO3含有Na+数为0.02NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
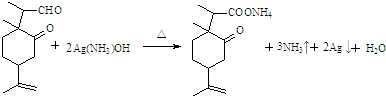
科目:高中化学 来源: 题型:解答题
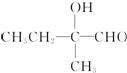 +2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$
+2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$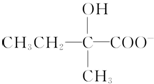 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.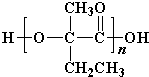 .
.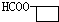 、
、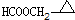 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com