
【题目】下列说法正确的是( )
A.22.4 L NO2中含有原子数为3 NA
B.1molNH3与1molNH![]() 所含电子数均为10NA
所含电子数均为10NA
C.14 g乙烯与丙烯的混合气体中所含碳原子数目为2NA
D.密闭容器中2 molSO2与1 mol O2在一定条件下充分反应,产物的分子数为2NA
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
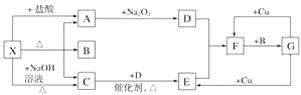
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/ |
乙醇 |
| 78.3 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 |
| 77 | 0.90 |
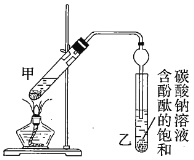
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制![]() 浓硫酸、
浓硫酸、![]() 乙醇(含
乙醇(含![]() )和
)和![]() 乙酸的混合溶液。
乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热![]() 。
。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)配制①中混合溶液的方法为_______________________________;反应中浓硫酸的作用是____________________________;写出制取乙酸乙酯的反应的化学方程式:____________________________(标出![]() )。
)。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因是____________________________;步骤③所观察到的现象是_______________________________________;欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有___________;分离时,乙酸乙酯应从仪器_____________(填“下口放”或“上口倒”)出。
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
实验 | 乙醇/ | 乙酸/ | 乙酸乙酯/ |
① | 2 | 2 | 1.33 |
② | 3 | 2 | 1.57 |
③ | 4 | 2 | x |
④ | 5 | 2 | 1.76 |
⑤ | 2 | 3 | 1.55 |
表中数据x的范围是__________________;实验①②⑤探究的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在生产生活中有着极其重要的作用。现以低品位镍红土矿(主要成分为镍的氧化物、Fe2O3·H2O和SiO2等)为原料制备兰尼镍的工艺流程如图所示:
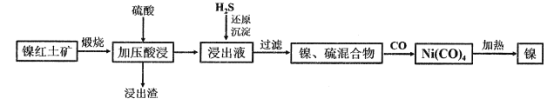
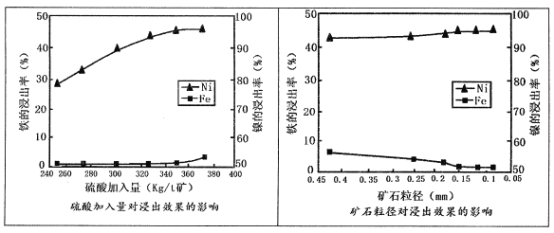
已知加压酸浸过程中的相关影响因素如下:
请回答:
(1)请根据图示,选择加压酸浸过程中硫酸的加入量和矿石粒径的最适宜条件为_______
A.260Kg/t矿;0.45mm B.320 Kg/t矿:0.25mm
C.350Kg/t矿;0.15mm D.380 Kg/t矿;0.05mm
(2)①已知镍红土矿煅烧后生成Ni2O3,而加压酸浸后浸出液中含有Ni2+,写出加压酸浸过程中镍元素所涉及的化学反应方程式____________。
②甲同学取该浸出液,控制pH为2~3,经过-系列操作,制取少量NiSO4·7H2O晶体。其控制pH为2~3的目的为____________________________________________________。
③乙同学取该浸出液,经多次处理,得到一定浓度的NiSO4溶液,往其中加入适量的NaClO和NaOH混合液,制得碱性镍电池电极材料NiOOH,该反应的离子方程式为____________。
(3)向浸出液中通入H2S气体,该反应的离子方程式为__________。
(4)下列说法正确的是________________
A.在煅烧过程中,空气宜选择从下往上的通入方式,使镍红土矿燃烧更充分
B.加压酸浸中,为加快反应速率,可选用浓硫酸
C.加压酸浸中,在最适宜条件下,浸出渣中的主要成份为SiO2和Fe2O3·H2O
D.CO为无色无味的有毒气体,故从镍硫混合物到镍的过程中,需注意通风并及时检测操作过程中是否有CO泄露
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述①能使酸性KMnO4溶液褪色、②可发生加聚反应、③可溶于水、④可溶于苯中、⑤能与浓硝酸发生取代反应、⑥所有的原子可能共平面,其中正确的是( )
)的下列叙述①能使酸性KMnO4溶液褪色、②可发生加聚反应、③可溶于水、④可溶于苯中、⑤能与浓硝酸发生取代反应、⑥所有的原子可能共平面,其中正确的是( )
A.仅①②④⑤B.仅①②⑤⑥C.仅①②④⑤⑥D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物;②煤和石油都是可再生能源;③![]() 和
和![]() 都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
A.①②④B.①⑤⑥C.②③④⑤D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com