
向x mL 2.0 mol·L-1的盐酸中投入a g镁铝合金,金属完全溶解,再加入y mL 1.0 mol·L-1的NaOH溶液沉淀达到最大值,且质量为(a+1.7) g,则下列说法不正确的是
A.x=2y
B.镁铝合金与盐酸反应时转移电子的数目为0.1NA
C.镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12 L
D.a的取值范围为0.9 g<a<1.2 g
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:简答题
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质
都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更
高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
 ③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
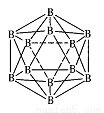
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原予(如图)
其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构
类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确
定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原
子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
下列图示与对应的叙述相符的是

A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化
B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强
C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
下列离子方程式的书写与结论均合理的是
选项 | 离子方程式 | 结论 |
A | AgCl(s) + I-( aq) | 溶解度:AgI > AgCl |
B | Fe2++ H2O2 +2H+= Fe3++2H2O | 氧化性:H2O2 > Fe3+ |
C | CO32- + CO2 + H2O = 2HCO3- | 稳定性:HCO3- > CO32- |
D | NH3 + H3O+=NH4++ H2O | 得质子能力:NH3 > H2O |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是
A.原混合物中CuO与Fe2O3物质的量的比为1∶2
B.原混合物中CuO与Fe2O3的质量比为2∶1
C.吸收CO2后溶液中一定有Ba(HCO3)2
D.反应中生成的CO2体积为1.792 L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
500 mL NaNO3和Cu(NO3)2的混合溶液中c( NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(Na+)=0.2 mol·L-1
B.电解后溶液中c(H+)=0.2 mol·L-1
C.上述电解过程中共转移0.4 mol电子
D.电解后得到的Cu的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:填空题
【物质结构与性质】
天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。
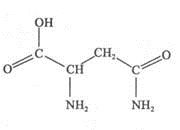
(1)天冬酰胺所含元素中 (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见下表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3o | 一60.75 |
H2Se | 1.47 | 91.0o | 一41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:填空题
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:_______________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_______________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是___。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
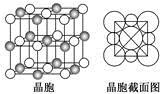
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
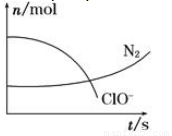
A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO- , 还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5∶2
D.若生成2.24 L N2(标准状况),则转移电子0.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com