
(14分)亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如图装置进行制取。
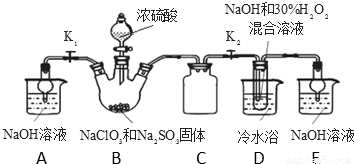
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;② ;③ ;④ 得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准液体积的平均值为V mL(已知:I2+2S2O32-= 2I-+S4O62-)。请计算所称取的样品中NaClO2的物质的量为 。
科目:高中化学 来源:2016届辽宁省高三10月月考化学试卷(解析版) 题型:选择题
下列离子方程式的书写及评价均合理的是
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 mol FeI2溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO3-+OH-===MgCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性: H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是
A.Na+、Ba2+、NO3-、CO32- B.Fe2+、Na+、SO42-、NO3-
C.Mg2+、NH4+、SO42-、Cl- D.Ba2+、K+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期10月月考化学试卷(解析版) 题型:实验题
某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为______ mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为___________mL。

(2)测定NO的体积
①从如图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是_______。
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是__________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中______(填“有”或“没有”)NO产生,作此判断的依据是_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下期末化学试卷(解析版) 题型:填空题
(14分)某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子 质量为64)。按照实验步骤依次回答下列问题:
质量为64)。按照实验步骤依次回答下列问题:
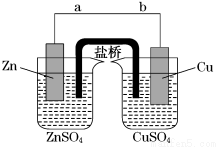
(1)导线中电子流向为____________(用a、b表示)。
(2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示) ;
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。
正极反应_____________;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。
②2C2H2+5O2 4CO2+2H2O:_____________。
4CO2+2H2O:_____________。
③6H2O+6CO2 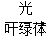 C6H12O6(葡萄糖)+6O
C6H12O6(葡萄糖)+6O 2:__________。
2:__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二下期末化学试卷(解析版) 题型:填空题
(1~5小题每空2分,6小题3分,共17分)
以下是实验室常用的部分仪器,请回答下列问题


(1)序号为⑥和⑩的仪器的名称分别为________、________。
(2)在过滤操作中,必须用到上述仪器中的___(填序号),次外,上图中还缺少的玻璃仪器 (填名称)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)仪器上标有温度的是_______(填序号)。
(5)如图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是

A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.②是温度计,读数是2.5 ℃
(6)丙同学想用如图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置 。
。

查看答案和解析>>
科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
化学是人类创造新物质的工具。下列各种物质的现代工业生产原理或过程的描述与事实不相符的是
A.用电解法制取Na、Mg、Al
B.电解熔融NaCl制Cl2
C.以硫或硫铁矿为原料通过接触法制硫酸
D.制硅:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高一上第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在标准状况下,1 mol酒精的体积是22.4 L
B.1 mol氢气所占的体积一定是22.4 L
C.标准状况下,6.02×1023个水分子所占有的体积约是22.4 L
D.标准状况下,28 g N2与CO的混合气体,体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com