
【题目】根据所学知识,完成问题:
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式. 正极 , 负极 , 电解质溶液 , 电极反应式、 .
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A.称量的是长期暴露在空气中的NaOH
B.容量瓶不干燥
C.将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制.
D.混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切.
【答案】
(1)C;Zn;FeCl3溶液;Zn﹣2e﹣=Zn2+;Fe3++e﹣=Fe2+
(2)CE
【解析】解:(1)由反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,电极反应为Zn﹣2e﹣=Zn2+ , 正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电极反应式为Fe3++e﹣=Fe2+ , 电解质溶液为FeCl3 , 所以答案是:C;Zn;FeCl3溶液;Zn﹣2e﹣=Zn2+;Fe3++e﹣=Fe2+;(2)A、称量的是长期暴露在空气中的NaOH,则由于氢氧化钠变质,导致氢氧化钠偏少,根据c= ![]() 可得配制的溶液浓度偏低,故A错误;B、容量瓶中有少量的蒸馏水不影响溶液体积、溶质的物质的量,所以不影响配制结果,故B错误;C、;将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中,则根据溶液热胀冷缩,所以到室温时体积偏小,根据c=
可得配制的溶液浓度偏低,故A错误;B、容量瓶中有少量的蒸馏水不影响溶液体积、溶质的物质的量,所以不影响配制结果,故B错误;C、;将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中,则根据溶液热胀冷缩,所以到室温时体积偏小,根据c= ![]() 可得,配制的溶液浓度偏高,故C正确;D、定容、摇匀后,由于容量瓶刻度线上方有残留的溶液,所以液面会低于刻度线,属于正常现象,不需要加入蒸馏水,否则会导致配制的溶液体积偏大,根据c=
可得,配制的溶液浓度偏高,故C正确;D、定容、摇匀后,由于容量瓶刻度线上方有残留的溶液,所以液面会低于刻度线,属于正常现象,不需要加入蒸馏水,否则会导致配制的溶液体积偏大,根据c= ![]() 可得,配制的溶液浓度偏低,故D错误;E、定容时俯视容量瓶刻度线,加入的蒸馏水在刻度线下方,即配制的溶液体积偏小,根据c=
可得,配制的溶液浓度偏低,故D错误;E、定容时俯视容量瓶刻度线,加入的蒸馏水在刻度线下方,即配制的溶液体积偏小,根据c= ![]() 可得,配制的溶液浓度偏高,故E正确;故选CE.
可得,配制的溶液浓度偏高,故E正确;故选CE.


科目:高中化学 来源: 题型:
【题目】某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( ) 
A.稀H2SO4
B.Na2SO4溶液
C.Na2CO3溶液
D.Na2SiO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹分别接c、d两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙中盛放的溶液分别为( ) 
A.NaHCO3饱和溶液、12 molL﹣1 盐酸,18.4 molL﹣1 H2SO4
B.Na2CO3饱和溶液、2 molL﹣1 H2SO4、NaOH饱和溶液
C.NaOH饱和溶液、2 molL﹣1 H2SO4、18.4 molL﹣1 H2SO4
D.18.4 molL﹣1 H2SO4、NaOH饱和溶液、18.4 molL﹣1 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺﹣1,2﹣二甲基环丙烷和反﹣1,2﹣二甲基环丙烷可发生如图1转化:
该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数.回答下列问题:
(1)已知:t1温度下,k(正)=0.006s﹣1 , k(逆)=0.002s﹣1 , 该温度下反应的平衡常数值K1=;该反应的活化能Ea(正)小于Ea(逆),则△H0(填“小于”“等于”或“大于”).
(2)t2温度下,图2中能表示顺式异构体的质量分数随时间变化的曲线是(填曲线编号),平衡常数值K2=;温度t1t2(填“小于”“等于”或“大于”),判断理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A.1 mol任何物质都含有6.02×1023个原子
B.0.012 kg 12C约含有6.02×1023个碳原子
C.阿伏加德罗常数表示的粒子“集体”就是1 mol
D.使用摩尔这一单位时必须指明粒子的名称
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是同学们经常使用的某品牌修正液包装标签.小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是( ) 
A.修正液是一种胶体,均一、稳定
B.修正液中含有有毒的化学物质
C.修正液的成分对纸张不具腐蚀性
D.修正液的溶剂易挥发、易燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】32g Cu与一定量的浓硫酸加热后,恰好完全反应,反应方程式如下:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O问:
CuSO4+SO2↑+2H2O问:
(1)得到SO2气体的体积(标准状况下)是多少?
(2)把所得的CuSO4 配制成250mL CuSO4溶液,所得溶液中溶质的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于溶液中某些离子的检验及结论一定正确的是( )
A.加入足量稀盐酸无沉淀,再加入氯化钡溶液后有白色沉淀产生,一定有SO ![]()
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO ![]()
C.无色试液加入NaOH溶液,试管口湿润的红色石蕊试纸未变蓝,结论:试液中无NH ![]()
D.无色溶液中加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得 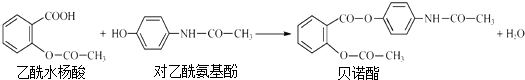
下列有关叙述正确的是( )
A.1mol贝诺酯分子可与7molH2完全反应
B.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
C.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
D.乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com