
【题目】某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( ) 
A.稀H2SO4
B.Na2SO4溶液
C.Na2CO3溶液
D.Na2SiO3溶液
科目:高中化学 来源: 题型:
【题目】图是一种试验某气体化学性质的实验装置.在A处通入氯气,图中B为开关,关闭B时,C中红色布条颜色无变化;打开B时,C处红色布条颜色褪去.由此做出的判断正确的是( ) 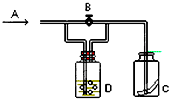
A.D中可以是水
B.D中可以是饱和食盐水
C.D中不可能是浓H2SO4
D.通入的氯气中含有水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000molL﹣1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 .
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中固体物质可以完全溶解的是
A. 1molMnO2与含2molH2O2的溶液共热
B. 1molCu投入含4molHNO3的浓硝酸中
C. 1mol铜投入含2molH2SO4的浓硫酸中共热
D. 常温下1mol铝片投入到足量浓硝酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了比较甲、乙、丙三种微生物所产生的淀粉酶的活性,某生物兴趣小组以三种微生物提取液(提取液中淀粉酶浓度相同)为材料进行了如下实验。

(1)表中A的数值为_______,F的颜色深浅程度为_______(用“+”或“-”表示)。
(2)该实验的自变量是___________________,无关变量有___________________(写出两种即可)。
(3)根据上述结果得出的结论是:不同来源的淀粉酶,虽然酶的浓度相同,但活性不同。造成实验中三种酶活性差异的直接原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称: , Q的原子结构示意图;R在周期表中的位置为 .
(2)Q2Z电子式为: , Q2Z2含的化学键类型为: .
(3)R、Z分别形成简单离子的半径大小:(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成问题:
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式. 正极 , 负极 , 电解质溶液 , 电极反应式、 .
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A.称量的是长期暴露在空气中的NaOH
B.容量瓶不干燥
C.将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制.
D.混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com