
【题目】有机物J是一种消炎镇痛药,下图为J的合成路线(部分产物和反应条件省略):

已知部分信息如下:
①![]() (此类物质易与水、酸等反应)
(此类物质易与水、酸等反应)
②![]()
回答下列问题:
(1)A中官能团的名称是_________,D + I→J的反应类型为___________。
(2)反应B→C的化学方程式为__________________。
(3)E→F的反应条件为___________,在质谱仪上E的最大质荷比为________。
(4)J有多种同分异构体,其中满足下列条件,且苯环上一氯代物只有两种的异构体的结构简式为________________。
a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应;c.能发生水解反应
(5)证明G已部分生成H的实验方案是__________________。
(6)参照上述流程,设计以 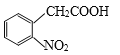 为原料,制备
为原料,制备 的合成路线(无机试剂任选)。_______________________________。
的合成路线(无机试剂任选)。_______________________________。
【答案】碳碳双键 取代反应 2CH3CHO +O2![]() 2CH3COOH FeBr3(Fe)作催化剂 78
2CH3COOH FeBr3(Fe)作催化剂 78 ![]() 取少量样品滴加FeCl3溶液,溶液变紫
取少量样品滴加FeCl3溶液,溶液变紫 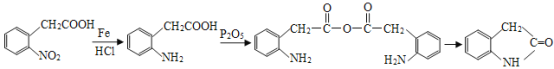
【解析】
根据A的分子式可知,A为乙烯,乙烯催化氧化生成B,B为乙醛;乙醛继续氧化生成C,C为乙酸;根据信息①,2分子乙酸反应生成D,D为乙酸酐(![]() );根据F为溴苯,E可能为苯;结合I的结构可知,溴苯发生硝化反应对位取代生成G,G为
);根据F为溴苯,E可能为苯;结合I的结构可知,溴苯发生硝化反应对位取代生成G,G为![]() ,G水解后酸化生成H。H为
,G水解后酸化生成H。H为![]() ;根据信息②,H中硝基被还原生成氨基;D与I发生取代反应生成J(
;根据信息②,H中硝基被还原生成氨基;D与I发生取代反应生成J(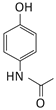 )。据此分析解答。
)。据此分析解答。
(1)A为乙烯,还原的官能团为碳碳双键,根据流程图中产物J的结构和D与I的结构可知,D + I→J的反应类型为取代反应,故答案为:碳碳双键;取代反应;
(2)反应B→C为乙醛催化氧化生成乙酸,反应的化学方程式为2CH3CHO +O2![]() 2CH3COOH,故答案为:2CH3CHO +O2
2CH3COOH,故答案为:2CH3CHO +O2![]() 2CH3COOH;
2CH3COOH;
(3)E→F为苯的溴代反应,反应条件为FeBr3(Fe)作催化剂,苯的相对分子质量为78 ,在质谱仪上E的最大质荷比为78,故答案为:FeBr3(Fe)作催化剂;78;
(4)J( )有多种同分异构体,a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应,说明含有醛基;c.能发生水解反应,说明含有酯基,结合J的分子式可知,该同分异构体为甲酸酯;且苯环上一氯代物只有两种,满足条件的同分异构体为
)有多种同分异构体,a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应,说明含有醛基;c.能发生水解反应,说明含有酯基,结合J的分子式可知,该同分异构体为甲酸酯;且苯环上一氯代物只有两种,满足条件的同分异构体为![]() ,故答案为:
,故答案为:![]() ;
;
(5)要证明G(![]() )已部分生成H(
)已部分生成H(![]() ),只需要证明有酚羟基生成,可以通过滴加FeCl3溶液,溶液变紫来验证,故答案为:取少量样品滴加FeCl3溶液,溶液变紫;
),只需要证明有酚羟基生成,可以通过滴加FeCl3溶液,溶液变紫来验证,故答案为:取少量样品滴加FeCl3溶液,溶液变紫;
(6)以 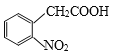 为原料,制备
为原料,制备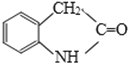 ,根据题干流程图中D和I反应生成J的提示,需要合成酸酐,并且将硝基转化为氨基,结合信息①②将
,根据题干流程图中D和I反应生成J的提示,需要合成酸酐,并且将硝基转化为氨基,结合信息①②将 中羧基转化为酸酐,硝基转化为氨基即可,因此合成路线为
中羧基转化为酸酐,硝基转化为氨基即可,因此合成路线为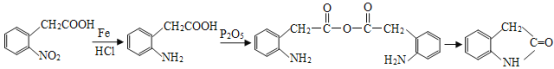 ,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2019/07/19/08/b412adcb/SYS201907190803093802717524_DA/SYS201907190803093802717524_DA.012.png" width="554" height="69" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。
,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2019/07/19/08/b412adcb/SYS201907190803093802717524_DA/SYS201907190803093802717524_DA.012.png" width="554" height="69" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。


科目:高中化学 来源: 题型:
【题目】利用氟磷灰石[主要成分Ca5(PO4)3F生产磷酸主要有热法和湿法两种方法。其流程如下:

热法:工业上将氟磷灰石、焦炭和石英砂(SiO2)混合后,在电炉中加热到1500℃生成白磷(P4)、SiF4、CO,白磷在空气中燃烧生成五氧化二磷,再经水化制成粗磷酸。
湿法:武汉化工研究院为技术攻关,实验室模拟生产磷酸的流程。
(1)配平步骤I反应的化学方程式:
____Ca5(PO4)3F+ ____C+ ____SiO2=____SiF4↑+ ___P4+____CO↑+____CaSiO3。其中氧化剂是______。
(2)湿法中粉碎氟磷灰石的目的是___________。
(3)浸取槽中发生反应的化学方程式________;浸取槽不能使用玻璃器皿的原因___________。
(4)探究中发现,65℃、一定流速下鼓气(鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出),并通过控制盐酸的用量减少后续除氟工艺。其他条件不变,盐酸实际用量/理论用量与所得的磷酸中氟含量及磷酸的浸取率如图所示。

①选择盐酸用量:盐酸实际用量/理论用量的范围为________(填字母代号)时磷酸浸取率较高且氟含量较低。
A.0.95~1.00 B.1.00~1.05
C. 1.05~1.10 D.1.15~1.20
②盐酸稍过量,氟含量降低的原因是___________。
③盐酸过量较多,氟含量快速增加的可能原因是___________。
(5)通过双指示剂方法测定浸取液中盐酸和磷酸的浓度。实验如下:每次取10.0mL浸取液,用1.0 mol·L-1NaOH溶液滴定,分别用不同的指示剂,滴定结果见表。含磷微粒在不同pH下物质的量分数如图所示。(甲基橙的变色范围为3.1~4.4,百里酚酞的变色范围为9.4~10.6)


则浸取液中c(HCl)=___________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010 mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是___________________,“沉渣2”的主要成分是_____,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________。
(2)用离子方程式解释加入NH4F “除Ca”的过程________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3:2,此时Ni单质所发生的化学方程式为_______。
(4)“操作X”是________、________
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为__________________。
(6)根据上表数据,计算当0.010 mol/L NiSO4溶液中Ni2+完全沉淀时的c(Ni2+)= ____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是( )
A. 如果继续通入一定量某气体使体系压强增大,平衡将正向移动
B. 此时,X的正反应速率是Y的逆反应速率的π/n倍
C. 如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小
D. 如果增加X的物质的量,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用如图装置来测定过氧化钠的质量分数。

①装置中仪器a的名称是_________,装置D的作用是________________;
②将仪器连接好以后,必须进行的第一步操作是_____________________;
③写出装置C中发生主要反应的化学方程式_______________________;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是________(填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
A. CuS的溶解度比MnS的溶解度小
B. 该反应达到平衡时:c(Cu2+)=c(Mn2+)
C. 往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D. 该反应平衡常数:K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用如图所示装置制取纯净的无水CuCl2。试回答下列问题:

(1)写出烧瓶中发生反应的化学方程式和离子方程式:__________________________。
(2)B处盛有饱和食盐水(或水),其作用是_____________。
(3)C处盛放的试剂__________(填名称),其作用是_____________。
(4)E处盛有_______(填名称),发生反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com