
| A、石英只能用于生产光导纤维 |
| B、从海水提取物质都必须通过化学反应才能实现 |
| C、二氧化硫可广泛用于食品的漂白 |
| D、次氯酸钠溶液可用于环境的消毒杀菌 |
科目:高中化学 来源: 题型:
235 92 |
235 92 |
| A、92 | B、235 |
| C、143 | D、327 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4和C3H8 |
| B、CH4和C3H4 |
| C、C2H6和C3H4 |
| D、C2H2和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
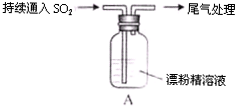 | i液面上方出现白雾; ii稍后,出现浑浊,溶液变为黄绿色; iii稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
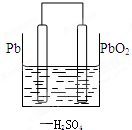 (1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为
(1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为查看答案和解析>>
科目:高中化学 来源: 题型:
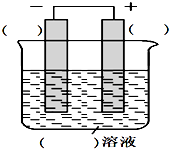 下列是构成原电池的实验方案,请按要求回答下列问题:
下列是构成原电池的实验方案,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3、NaOH、BaCl2和盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、在第③④⑤步中溴元素均被氧化 |
| D、由海水提取的金属镁能与金属铝、氢氧化钠溶液在一定条件下形成原电池,金属镁作该原电池正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com