
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,Mr=990)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是________。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是________(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为________。
(3)滤液2中可循环利用的溶质为________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5 mol·L-1,则此时 c(SO42-)=________mol·L-1。
(4)步骤⑥合成三盐的化学方程式为________。若得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________。
【答案】 将PbSO4转化为PbCO3,提高铅的利用率 适当升高温度(或适当增大硝酸浓度或减小沉淀粒直径等其他合理答案) 3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O HNO3 1.0×10-3 4PbSO4+6NaOH![]() 3Na2SO4+3PbO·PbSO4·H2O+2H2O 52%
3Na2SO4+3PbO·PbSO4·H2O+2H2O 52%
【解析】试题分析:(1) 根据Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13,碳酸铅比硫酸铅更难溶,所以硫酸铅可以转化为碳酸铅;(2)根据影响反应速率的因素分析提高酸溶速率的方法;铅与硝酸反应生成Pb(NO3)2和NO、水;(3)步骤④沉铅是硝酸铅与硫酸反应生成硫酸铅沉淀和硝酸;根据Ksp(PbSO4)=1.82×10-8计算c(SO42-);(4)步骤⑥氢氧化钠、PbSO4生成3PbO·PbSO4·H2O;根据铅元素守恒计算铅泥中铅元素的质量分数。
解析:(1)碳酸铅比硫酸铅更难溶,所以硫酸铅可以转化为碳酸铅,步骤①转化的目的是将PbSO4转化为PbCO3,提高铅的利用率;(2)适当升高温度、增大硝酸浓度都能提高酸溶速率;铅与硝酸反应生成Pb(NO3)2和NO、水的离子方程式是3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;(3)步骤④沉铅是硝酸铅与硫酸反应生成硫酸铅沉淀和硝酸,所以可以循环利用的物质是硝酸; c(SO42-)=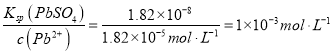 ;(4)根据质量守恒,氢氧化钠、PbSO4生成3PbO·PbSO4·H2O的化学方程式是4PbSO4+6NaOH
;(4)根据质量守恒,氢氧化钠、PbSO4生成3PbO·PbSO4·H2O的化学方程式是4PbSO4+6NaOH![]() 3Na2SO4+3PbO·PbSO4·H2O+2H2O;设铅泥中铅元素的质量分数为x,根据铅元素质量守恒
3Na2SO4+3PbO·PbSO4·H2O+2H2O;设铅泥中铅元素的质量分数为x,根据铅元素质量守恒![]() ,解得x=0.52=52%。
,解得x=0.52=52%。


科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,

理由:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 合成硫酸的工业尾气可以直接排入大气
B. 进入接触室的气体,必须先经净化、干燥
C. 从沸腾炉中排出的炉渣可以作为肥料
D. 在高温、高压下由SO2和O2合成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的结构、性质的叙述正确的是( )
A. 苯、油脂均不能使酸性KMnO4溶液褪色
B. 甲烷和C12的反应与乙烯和Br2的反应属于同一类型的反应
C. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D. 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入干燥Cl2 , 关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( ) 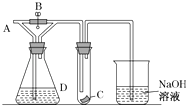
A.浓H2SO4
B.NaOH溶液
C.浓盐酸
D.饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g)![]() PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
A. 10 min内,v(Cl2) = 0.04 mol/(L·min)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的![]()
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列各组离子能大量共存的是( )
A. Fe2+、K+、Cl-、NO3- B. Ag+、Na+、NO3-、Cl-
C. Zn2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是
A. 硅酸钠
B. 碳酸钠,硅酸钠
C. 碳酸钠,二氧化硅
D. 二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com