
【题目】C60、金刚石、石墨、二氧化碳和氯化铯的结构模型如图所示(石墨仅表示出其中的一层结构):
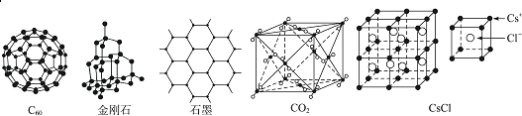
(1)C60、金刚石和石墨三者的关系是互为_____。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于_____(填“原子”或“分子”)晶体。
(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有硅﹣硅单键的数目约是_____NA。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是_____。
(5)观察CO2分子晶体结构的一部分,试说明每个CO2分子周围有_____个与之紧邻且等距的CO2分子;该结构单元平均占有_____个CO2分子。
(6)观察图形推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为_____,每个Cs+配位数为_____。
【答案】B 分子 2 2 12 4 6 8
【解析】
(1)同种元素的不同单质互称同素异形体;
(2)根据晶体构成微粒判断晶体类型;
(3)每个硅原子含有2个硅硅键;
(4)利用均摊法计算;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;
(6)根据CsCl晶体的晶胞分析。
(1)同种元素的不同单质互称同素异形体,C60、金刚石和石墨是碳元素的不同单质,属于同素异形体;故答案为:B。
(2)C60中构成微粒是分子,所以属于分子晶体,故答案为:分子。
(3)每个硅原子含有2个硅硅键,则1mol硅晶体中含有硅硅单键的数目约是2NA个,故答案为:2。
(4)石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6×![]() =2,故答案为:2。
=2,故答案为:2。
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;晶胞中分子数目=8×![]() +6×
+6×![]() =4;故答案为:12;4。
=4;故答案为:12;4。
(6)以大立方体体心的Cs+为例,与其距离相等且距离最近的Cs+位于大立方体的六个面心,所以每个Cs+周围与它最近且距离为a的的Cs+共有3×8×![]() =6个;每个Cs+周围紧邻且等距的Cl-数目=1×8=8,所以每个Cs+配位数为8,故答案为:6;8。
=6个;每个Cs+周围紧邻且等距的Cl-数目=1×8=8,所以每个Cs+配位数为8,故答案为:6;8。


科目:高中化学 来源: 题型:
【题目】有机物![]() 有多种同分异构体,其中属于酯类且氯原子直接连接在苯环上的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中属于酯类且氯原子直接连接在苯环上的同分异构体有多少种(不考虑立体异构)
A.19种 B.9种 C.15种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为: FeC2O4+K3[Fe(CN)6] →Fe3[Fe(CN)6]2+______,配平并完成该显色反应的化学方程式。
2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为: FeC2O4+K3[Fe(CN)6] →Fe3[Fe(CN)6]2+______,配平并完成该显色反应的化学方程式。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
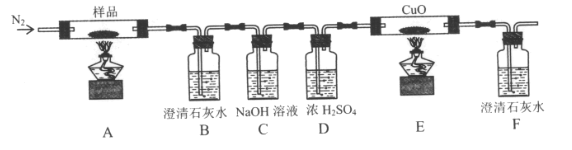
①通入氮气的目的是_________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有_______,____。
③样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(1)盐酸浸取时需要适当加热的原因是_________。
(2)用37%的盐酸配制15%的盐酸需用到的仪器有________(填字母)
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(3)滤渣I的成分为__________;
(4)Mg(OH)2的溶度积常数Ksp=_______,加入H2C2O4时发生的离子反应为_______,加入H2C2O4应避免过量,其原因是_________。
(5)母液中除了含有Ba2+、Cl—外,还含有大量的_________(填离子符号);
(6)滤渣III(不含结晶水)是结石的主要成分滤渣Ⅲ经过洗涤干燥后在空气中进行热重分析,取128.0g该纯净物,在200~470℃灼烧,最后得到100.0g产物,200~470℃时发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①不同核素之间形成的共价键一定是极性键②当一个碳原子连接四个不同的原子或原子团时,该碳原子叫手性碳原子③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O,CO2这样的分子⑤冰中存在极性共价键和氢键两种化学键的作用⑥熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、电解质、盐⑦氨水中大部分NH3与H2O以氢键(用“ …”表示)结合成NH3H2O分子,根据氨水的性质可知NH3H2O的结构式为⑧σ键重叠方式为头碰头,成镜像对称;键重叠方式为肩并肩,成轴对称⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键.
…”表示)结合成NH3H2O分子,根据氨水的性质可知NH3H2O的结构式为⑧σ键重叠方式为头碰头,成镜像对称;键重叠方式为肩并肩,成轴对称⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键.
A. ②⑥B. ①②⑥C. ②⑤⑥⑧D. ③④⑥⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-对甲苯丙烯酸甲酯(E) 是一种用于合成抗血栓药的中间体,其合成部分路线如下:
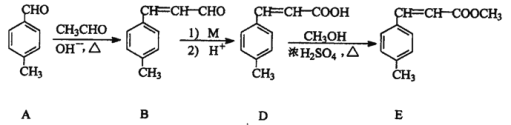
(1)B中含有的官能团名称为_______、__________。
(2)由A转化为B,反应分两步完成,请判断反应类型依次为___________,_________。
(3)D 的分子式为_________________。
(4)1mol E最多能与___________mol 的氢气发生加成反应。
(5)1molB与5mol H2在适当条件下完全加成后,产物分子中含手性碳原子的数目为_____;
(6)D转化为E 的化学反应方程式为________________,
(7)试剂M 可以选用下列中的_________。
A.NaOH 溶液 B.银氨溶液
C.酸性高锰酸钾溶液 D.新制Cu(OH)2 悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如下图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法正确的是

A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
D. b极的电极反应式为:MnO2+2H2O+2e-=Mn2++4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com