
【题目】3-对甲苯丙烯酸甲酯(E) 是一种用于合成抗血栓药的中间体,其合成部分路线如下:
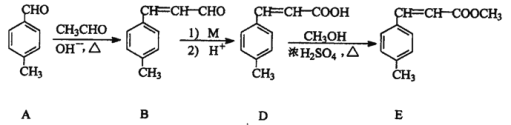
(1)B中含有的官能团名称为_______、__________。
(2)由A转化为B,反应分两步完成,请判断反应类型依次为___________,_________。
(3)D 的分子式为_________________。
(4)1mol E最多能与___________mol 的氢气发生加成反应。
(5)1molB与5mol H2在适当条件下完全加成后,产物分子中含手性碳原子的数目为_____;
(6)D转化为E 的化学反应方程式为________________,
(7)试剂M 可以选用下列中的_________。
A.NaOH 溶液 B.银氨溶液
C.酸性高锰酸钾溶液 D.新制Cu(OH)2 悬浊液
【答案】碳碳双键 醛基 加成 消去 C10H10O2 4 0 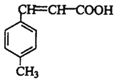 +CH3OH
+CH3OH![]()
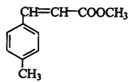 +H2O BD
+H2O BD
【解析】
(1)B结构简式为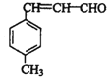 ,可根据其结构简式推断其官能团;
,可根据其结构简式推断其官能团;
(2)A是![]() ,与乙醛先发生醛基的加成反应,然后发生醇的消去反应得到B
,与乙醛先发生醛基的加成反应,然后发生醇的消去反应得到B ;
;
与A互为同分异构体,则分子式与A相同,但结构不同;
(3)根据D的结构简式可得其分子式;
(4)E分子中含有的苯环及碳碳双键能够发生加成反应;
(5)B分子中含有1个苯环、一个碳碳双键、一个醛基,1molB与5mol H2在适当条件下完全加成反应,产物分子中若有1个碳原子连接4个不同的原子或原子团,则该碳原子为手性碳原子;
(6)D与甲醇在浓硫酸存在时,在加热条件下发生酯化反应产生E和水。
(7)M可以将B中的醛基氧化为羧基,但不能将碳碳双键氧化,说明M是弱氧化剂。
(1)根据B的结构简式 可知其中含有的官能团为碳碳双键和醛基;
可知其中含有的官能团为碳碳双键和醛基;
(2)A是对甲基苯甲醛,与乙醛发生加成反应产生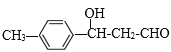 ,该物质再发生消去反应产生B:
,该物质再发生消去反应产生B:![]() ,因此反应类型依次为加成反应、消去反应;
,因此反应类型依次为加成反应、消去反应;
(3)D结构简式为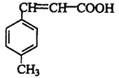 ,可知D分子式为C10H10O2;
,可知D分子式为C10H10O2;
(4)根据E分子 结构可知:E分子中含有1个苯环和1个碳碳双键能够与氢气发生加成反应,而含有的酯基不能发生加成反应,所以1molE最多可以与4molH2发生反应;
(5)B分子中含有1个苯环、一个碳碳双键、一个醛基,1molB与5mol H2在适当条件下完全加成反应,产物分子为![]() ,可知在该物质中不含有手性碳原子;
,可知在该物质中不含有手性碳原子;
(6)D与甲醇在浓硫酸存在时,在加热条件下发生酯化反应产生E和水。该反应的化学方程式为  +CH3OH
+CH3OH![]()
 +H2O;
+H2O;
(7)M可将醛基氧化生成羧基,应为弱氧化剂,可选用银氨溶液或氢氧化铜浊液,溴水、高锰酸钾也可与碳碳双键反应,不符合题意,故合理选项是BD;


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A. 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为(7/22.4)NA
B. 1 mol甲基(-CH3)所含的电子总数为9NA
C. 0.5 mol1,3-丁二烯分子中含有碳碳双键数为NA
D. 1 mol碳正离子(CH3+)所含的电子总数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石、石墨、二氧化碳和氯化铯的结构模型如图所示(石墨仅表示出其中的一层结构):
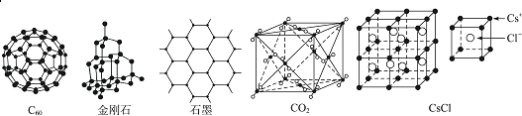
(1)C60、金刚石和石墨三者的关系是互为_____。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于_____(填“原子”或“分子”)晶体。
(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有硅﹣硅单键的数目约是_____NA。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是_____。
(5)观察CO2分子晶体结构的一部分,试说明每个CO2分子周围有_____个与之紧邻且等距的CO2分子;该结构单元平均占有_____个CO2分子。
(6)观察图形推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为_____,每个Cs+配位数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
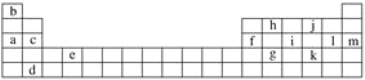
表中所列元素中:
属于短周期元素的有_____________________________________(填字母,下同);属于主族元素的有__________________________________________;e元素在元素周期表中的位置是第__________周期第__________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
(1)此时A的浓度为______;
(2)反应开始前放入容器中A、B的物质的量是_____________;
(3)B的平均反应速率是_________________;
(4)x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
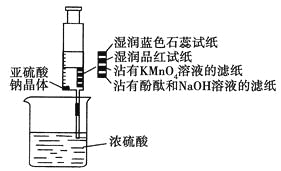
A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125molL-1min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学符号表征正确的是
A. 电解法精炼铜,阴极电极反应:Cu2++2e-== Cu
B. H2S在水溶液中的电离:H2S![]() 2H++ S2-
2H++ S2-
C. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4 (g)+2O2 (g) ==CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D. 碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.原子半径:![]()
B.热稳定性:![]()
C.N、O、F元素的非金属性依次减弱
D.P、S、![]() 元素最高价氧化物对应的水化物酸性依次增强
元素最高价氧化物对应的水化物酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com