
【题目】下列叙述不正确的是( )
A.原子半径:![]()
B.热稳定性:![]()
C.N、O、F元素的非金属性依次减弱
D.P、S、![]() 元素最高价氧化物对应的水化物酸性依次增强
元素最高价氧化物对应的水化物酸性依次增强
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】3-对甲苯丙烯酸甲酯(E) 是一种用于合成抗血栓药的中间体,其合成部分路线如下:
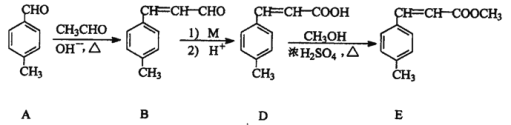
(1)B中含有的官能团名称为_______、__________。
(2)由A转化为B,反应分两步完成,请判断反应类型依次为___________,_________。
(3)D 的分子式为_________________。
(4)1mol E最多能与___________mol 的氢气发生加成反应。
(5)1molB与5mol H2在适当条件下完全加成后,产物分子中含手性碳原子的数目为_____;
(6)D转化为E 的化学反应方程式为________________,
(7)试剂M 可以选用下列中的_________。
A.NaOH 溶液 B.银氨溶液
C.酸性高锰酸钾溶液 D.新制Cu(OH)2 悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如下图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法正确的是

A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
D. b极的电极反应式为:MnO2+2H2O+2e-=Mn2++4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)1918年,德国化学家哈伯因发明工业合成氨(N2(g)+3H2(g)![]() 2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
(1)若将1molN2和3molH2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为_____mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是____。
a. v(N2)正=3v(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)1998年,两位希腊化学家提出了电解合成氨的新思路:
(4)采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
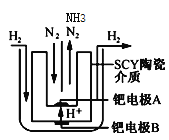
钯电极A是电解池的___极(填“阳”或“阴”),阳极反应式为________。
(方法三)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ/mol
(5)写出上述固氮反应的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是( )
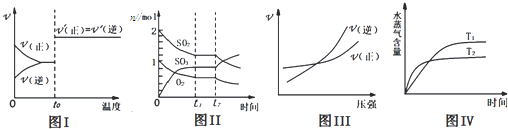
A.图I:反应H2+I22HI达平衡后,升高温度时反应速率随时间的变化
B.图Ⅱ:反应2SO2+O22SO3达平衡后,缩小容器体积时各成分的物质的量变化
C.图III:反应N2+3H22NH3在温度一定的情况下,反应速率与压强的关系
D.图IV:反应CO2(g)+H2(g)CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如图:
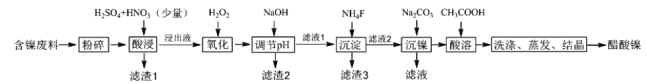
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
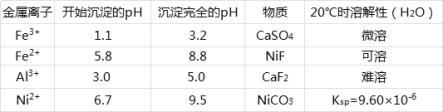
(1)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的离子方程式___。
(2)滤渣1和滤渣3主要成分的化学式分别是___、____。
(3)写出氧化步骤中加入过氧化氢发生反应的离子方程式______。
(4)调节pH步骤中,溶液pH的调节范围是____。
(5)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)<10-5mol/L],则需要加入碳酸钠固体的物质的量最少为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是
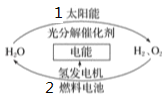
A. 过程1是放热反应
B. 过程2可将化学能转化为电能
C. 氢能源可从自然界直接获取,是一次能源
D. 氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列属于吸热反应的是________;属于放热反应的是________。
①煅烧石灰石 ②木炭燃烧 ③酸碱中和 ④二氧化碳和碳高温反应
(2)![]() 熔点较低,易升华,溶于醇和醚,其与
熔点较低,易升华,溶于醇和醚,其与![]() 化学性质相似。由此可推断
化学性质相似。由此可推断![]() 的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,CO2是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热△H为-283kJ·mol-1,CO(g)+2H2(g)![]() CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
(2)向温度不同容积均为1 L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。

①Q___(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是___。
②t2时刻时,容器b中正反应速率__(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__;
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品。
①NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-):c(CO32-)=2:1,则所得溶液的pH=___[常温下Kl(H2CO3)=4.4×10-7、K2(HCO3-)=5×10-11]。
②在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是___。
(4)用甲醇作为燃料电池的原料,请写出在碱性介质中电池负极反应式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com