
����Ŀ����ѧ��һֱ���������˹��̵������о��������ж��ַ�����
������һ��1918�꣬�¹���ѧ�ҹ���������ҵ�ϳɰ���N2(g)+3H2(g)![]() 2NH3(g) H<0���ķ������ٻ�ŵ������ѧ����
2NH3(g) H<0���ķ������ٻ�ŵ������ѧ����
��1������1molN2��3molH2����1L���ܱ������У�5min��N2��Ũ��Ϊ0.8mol/L�����ʱ������N2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ_____mol/(L��min)��
��2����һ���¶��µĶ����ܱ������з���������Ӧ������������˵����Ӧ�Ѿ��ﵽƽ��״̬����____��
a. v(N2)��=3v(H2)��
b. ������������ܶȲ���ʱ����仯
c. ����������ķ�����������ʱ����仯
d. �����������ƽ����Է�����������ʱ����仯
��3���ϳɰ���Ӧ����������ѡ���У�������������ԭ�����͵���________��
��ʹ�ô��� �ڸ��� �۸�ѹ �ܼ�ʱ������Һ������ϵ�з������
A. �٢� B. �ڢ� C. �ۢ� D. �ڢ�
����������1998�꣬��λϣ����ѧ������˵��ϳɰ�����˼·��
��4�����ø����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ�ʵ���˸���(570��)��ѹ�¸�ת���ʵĵ�ⷨ�ϳɰ���ת���ʿɴﵽ78����װ������ͼ��
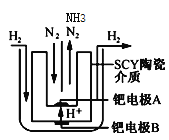
�ٵ缫A�ǵ��ص�___��(����������������)��������ӦʽΪ________��
�������������µ����˹��̵����о��������ڳ��¡���ѹ�����������£�N2�ڴ���������ˮ������Ӧ��ֱ�����ɰ�����������
��֪��N2(g)+3H2(g) ![]() 2NH3(g) ��H=��92 kJ��mol
2NH3(g) ��H=��92 kJ��mol
2H2(g)+O2(g)=2H2O(1) ��H=��571.6 kJ��mol
��5��д�������̵���Ӧ���Ȼ�ѧ����ʽ___________��
���𰸡�0.04 c d C �� H2��2e��=2H+ 2N2(g)+6H2O(I)=4NH3(g)+3O2(g) ��H=+1530.8kJ/mol
��������
��1������![]() ������N2��Ũ�ȱ仯��ʾ�ķ�Ӧ���ʣ�
������N2��Ũ�ȱ仯��ʾ�ķ�Ӧ���ʣ�
��2������ƽ��״̬��־�жϣ�
��3����������ԭ���ʺϽ���ƽ���ƶ���
��4��ԭ����е����������ϵõ����ӷ�����ԭ��Ӧ�������ڸ�����ʧ���ӷ���������Ӧ��
��5�����ݸ�˹���ɼ���2N2(g)+6H2O(I)=4NH3(g)+3O2(g)���ʱ䣻
��1������1molN2��3molH2����1L���ܱ������У�5min��N2��Ũ��Ϊ0.8mol/L��![]() 0.04 mol/(L��min)
0.04 mol/(L��min)
��2��a. ���淴Ӧ����֮�ȵ���ϵ���ȣ���Ӧ�ﵽƽ�⣬����3v(N2)��=v(H2)���ﵽƽ�⣬�ʲ�ѡa��
b. N2(g)+3H2(g)![]() 2NH3(g)�ں��������н��У��ܶ��Ǻ�����������������ܶȲ���ʱ����仯����һ��ƽ�⣬�ʲ�ѡb��
2NH3(g)�ں��������н��У��ܶ��Ǻ�����������������ܶȲ���ʱ����仯����һ��ƽ�⣬�ʲ�ѡb��
c. N2(g)+3H2(g)![]() 2NH3(g)��Ӧ����������������DZ�����������������ķ�����������ʱ����仯��һ��ƽ�⣬��ѡc��
2NH3(g)��Ӧ����������������DZ�����������������ķ�����������ʱ����仯��һ��ƽ�⣬��ѡc��
d. ����![]() �������������ƽ����Է��������DZ������������������ƽ����Է�����������ʱ����仯��һ��ƽ�⣬��ѡd��
�������������ƽ����Է��������DZ������������������ƽ����Է�����������ʱ����仯��һ��ƽ�⣬��ѡd��
��3���ٴ�������ʹƽ���ƶ�����������������ԭ�����ͣ��ʲ�ѡ�٣� ��N2(g)+3H2(g)![]() 2NH3(g) H<0�������¶ȣ�ƽ�������ƶ��������ڰ��������ɣ���������������ԭ�����ͣ��ʲ�ѡ�ڣ� ��N2(g)+3H2(g)
2NH3(g) H<0�������¶ȣ�ƽ�������ƶ��������ڰ��������ɣ���������������ԭ�����ͣ��ʲ�ѡ�ڣ� ��N2(g)+3H2(g)![]() 2NH3(g)������ѹǿ��ƽ�������ƶ������ڰ��������ɣ�������������ԭ�����ͣ���ѡ�ۣ��ܼ�ʱ������Һ������ϵ�з��������ƽ�������ƶ������ڰ��������ɣ�������������ԭ�����ͣ���ѡ�ܣ���C��ȷ��
2NH3(g)������ѹǿ��ƽ�������ƶ������ڰ��������ɣ�������������ԭ�����ͣ���ѡ�ۣ��ܼ�ʱ������Һ������ϵ�з��������ƽ�������ƶ������ڰ��������ɣ�������������ԭ�����ͣ���ѡ�ܣ���C��ȷ��
��4������ͼʾ��B�缫������ʧ�������������ӣ�����B��������A�������������缫��Ӧʽ��H2��2e��=2H+��
��5����N2(g)+3H2(g) ![]() 2NH3(g) ��H=��92 kJ��mol
2NH3(g) ��H=��92 kJ��mol
��2H2(g)+O2(g)=2H2O(1) ��H=��571.6 kJ��mol
���ݸ�˹���ɢ١�2���ڡ�3�� 2N2(g)+6H2O(I)=4NH3(g)+3O2(g) ��H=+1530.8kJ/mol


 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����ijһ��ѧԪ�ء�
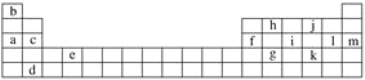
��������Ԫ���У�
���ڶ�����Ԫ�ص���_____________________________________������ĸ����ͬ������������Ԫ�ص���__________________________________________��eԪ����Ԫ�����ڱ��е�λ���ǵ�__________���ڵ�__________�塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ���ű�����ȷ����
A. ��ⷨ����ͭ�������缫��Ӧ��Cu2++2e��== Cu
B. H2S��ˮ��Һ�еĵ��룺H2S![]() 2H++ S2��
2H++ S2��
C. �����ȼ����Ϊ890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4 (g)��2O2 (g) ==CO2 (g)��2H2O (g) ��H����890.3 kJ��mol��1
D. ̼����ˮ������ӷ���ʽ��CO32��+2H2O![]() 2OH��+H2CO3
2OH��+H2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ɡ��ͪ������������ͪ��ƻ������һ�������·�Ӧ�Ƶ�
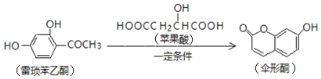
����˵������ȷ���ǣ� ��
A.һ���ӷ�Ӧ����������ͪ����3��̼̼˫��
B.ƻ�����һ�����۲�����![]()
C.1mol����ɡ��ͪ������NaOH��Һ��Ӧ����������2molNaOH
D.��Ӧ���漰���������л��ﶼ�ܸ�FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(NH3��BH3)��ؿ��ڳ����¹�����װ����ͼ��ʾ��δ���백����֮ǰ��������������ȣ���ط�ӦΪNH3��BH3+3H2O2�TNH4BO2+4H2O����֪�������е��������������˵����ȷ����
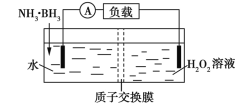
A. �����ĵ缫��ӦʽΪ2H++2![]() �TH2��
�TH2��
B. ��ع���ʱ��H+ͨ�����ӽ���Ĥ���ƶ�
C. ��ع���ʱ�����������ֱ�ų�H2��NH3
D. ����һ��ʱ���������������������Ϊ1.9 g�����·��ת��0.6 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ����н�������ʵ�飺
ʵ�� ���� |
|
|
|
|
���� | Fe����������� ��ɫ���壬��Һ�� �Ϸ������ɫ | Fe�������� �Ա仯 | ����������ɫ���ݣ����Ⱥ�Cu���������ɫ���壬��Һ���Ϸ������ɫ | Cu��������� ��ɫ���� |
��ش��������⣺
��1��������������ɫ��Ϊ����ɫ������ɫ������__________________�������ʽ����
��2�����е�����˵��Fe������______��������ԭ����________________________��
��3���ԱȢ٢��е�����______����������������������˵��ϡ�����������ǿ��Ũ���ᡣ
��4���ԱȢۢ��е�����˵�������ԣ�ϡ����______������>������<����Ũ���ᡣ
��5�������ڼ���ʱ�Ļ�ѧ��Ӧ����ʽΪ________________________���˷�Ӧ��ϡ��������ֳ��������⣬�����ֳ�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.ԭ�Ӱ뾶��![]()
B.���ȶ��ԣ�![]()
C.N��O��FԪ�صķǽ��������μ���
D.P��S��![]() Ԫ������������Ӧ��ˮ��������������ǿ
Ԫ������������Ӧ��ˮ��������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ƽ�ⳣ����H2CO3��HClO��HCO3���������ԣ�HClO��Cl2��Br2��Fe3+��I2�������й����ӷ�Ӧ�����ӷ���ʽ�������У���ȷ���ǣ�������
A.�����£�������Һ�У�![]() ��
��![]() ��
��![]() ��
��![]() �ܴ�������
�ܴ�������
B.����![]() ����Һ��ͨ��
����Һ��ͨ��![]() ��ַ�Ӧ��4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
��ַ�Ӧ��4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.��NaClO��Һ��ͨ������������̼�����ӷ���ʽ��ClO-+CO2+H2O=HClO+HCO3-
D.��![]() ��Һ�еμ�������ˮ���ټ���
��Һ�еμ�������ˮ���ټ���![]() ��Һ�����ã��л���ʳ�ɫ
��Һ�����ã��л���ʳ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���ǵ�������к�������Ԫ�أ�����������й�����
(1)д����Ԫ�ص�ԭ�ӽṹʾ��ͼ��_____________��
(2)�������еĵ���ת��Ϊ���Ļ�����Ĺ��̳�Ϊ�̵���������ʵ�̵ֹ�����_______
A��N2��H2��һ�������·�Ӧ����NH3
B����������ʱ�����е�N2��O2��������NO
C��NH3��������������NO
D��NH3��HNO3��Ӧ����NH4NO3
(3)д��ʵ������ȡ�����Ļ�ѧ��Ӧ����ʽ_______________��
(4)��ͼ��ʵ������ȡ������װ�ã���ָ��ͼ�д���֮����______________��

(5)����ͼװ�ý�����Ȫʵ�飬��ѹ�ιܵĽ�ͷʱ������_________��

(6)��ʵ����Ҫ�ռ�һ�����İ���Ӧ��ʲô�����ռ���____________��
(7)��д�������Ĵ�������Ӧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com