
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
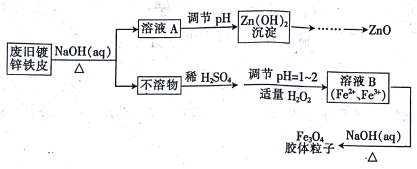
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
【答案】 Zn 不是 2H++Fe=Fe2++H2↑ 做氧化剂,将部分Fe2+氧化为Fe3+ 利用丁达尔效应 1.25 ![]()
【解析】本题考查化学工艺流程,(1)根据流程,加入NaOH溶液后,得到溶液A和不溶物,溶液A经过一系列的变化,得出氧化锌,因此锌与NaOH溶液发生反应,不溶物经过系列变化得到四氧化三铁胶体,说明铁不与氢氧化钠溶液反应;(2)氢氧化锌受热分解:Zn(OH)2![]() ZnO+H2O,此反应中没有化合价的变化,不属于氧化还原反应;(3)不溶物中含有Fe,Fe与硫酸反应生成FeSO4,Fe2+具有还原性,H2O2把部分Fe2+氧化成Fe3+;(5)胶体具有丁达尔效应,因此鉴别Fe3O4采用丁达尔效应,如果出现明亮的通路,说明生成了Fe3O4胶体;(6)445g焦硫酸的物质的量为445/178mol=2.5mol,其中有2.5molH2SO4和2.5molSO3,2.5molSO3能生成2.5molH2SO4,即2.5mol焦硫酸溶于水生成5molH2SO4,稀释过程中溶质的物质的量不变,因此该硫酸的浓度为5/4.00mol·L-1=1.25mol·L-1;(7)稀释过程中溶质物质的量不变,溶质物质的量为100/ρ1×10-3×4mol=0.4/ρ1mol,稀释后溶液的体积为(100+V) /ρ2mL,根据c=n/V,推出V=(
ZnO+H2O,此反应中没有化合价的变化,不属于氧化还原反应;(3)不溶物中含有Fe,Fe与硫酸反应生成FeSO4,Fe2+具有还原性,H2O2把部分Fe2+氧化成Fe3+;(5)胶体具有丁达尔效应,因此鉴别Fe3O4采用丁达尔效应,如果出现明亮的通路,说明生成了Fe3O4胶体;(6)445g焦硫酸的物质的量为445/178mol=2.5mol,其中有2.5molH2SO4和2.5molSO3,2.5molSO3能生成2.5molH2SO4,即2.5mol焦硫酸溶于水生成5molH2SO4,稀释过程中溶质的物质的量不变,因此该硫酸的浓度为5/4.00mol·L-1=1.25mol·L-1;(7)稀释过程中溶质物质的量不变,溶质物质的量为100/ρ1×10-3×4mol=0.4/ρ1mol,稀释后溶液的体积为(100+V) /ρ2mL,根据c=n/V,推出V=(![]() )mL。
)mL。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】有关下列两种溶液的说法中,正确的是( )
溶液①:0.2 mol·L-1CH3COONa溶液;溶液②:0.1 mol·L-1H2SO4溶液
A. 相同温度下,溶液中水的电离程度:溶液①<溶液②
B. 加水稀释溶液①,溶液中![]() 变大
变大
C. 等体积混合溶液①和溶液②,所得溶液中c(CH3COO-)+2c(SO![]() )=c(Na+)
)=c(Na+)
D. 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(SO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
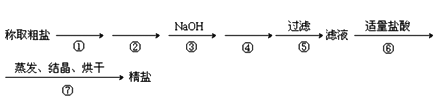
(1)第①步操作的名称是_____________,第②步加入的试剂化学式为______________。
(2)第④步加入试剂的化学式为___________________,相关的化学反应的离子方程式是____________________、____________________。
(3)第⑤步操作所需玻璃仪器是:烧杯、玻璃棒和__________(填名称)。
(4)实验过程中多次用到玻璃棒,其作用分别为①________;⑤____________;⑦____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)AgNO3的水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示):______________;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于_______中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(用离子方程式表示)______________。把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是________。
(3)用热的纯碱溶液洗涤餐具,原因是(用离子方程式表示)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物X、Y均为重要的工业原料,可由A和环己烯(![]() )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):

已知:ⅰ.X的结构简式是: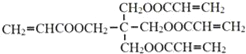
ⅱ.![]()
ⅲ.![]()
(1)X的化学式是____,A中含氧官能团的名称是_____;第①步反应的类型是___。
(2)下列有关说法正确的是_______。
a.H与苯酚可以用FeCl3溶液区分
b.G、H分别经一步反应都可得到环己烯
c.D的所有同分异构体在红外光谱仪中显示的信号(或数据)完全相同
d.试剂a是浓硫酸
e.反应②加高锰酸钾可以实现
(3)Y的结构简式是_____________________________________。
(4)已知1mo1W与1mol H2经加成反应生成1molE,写出W的同分异构体能同时满足下列条件的结构简式是_________________________________。
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生水解反应
③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Ca2+、Mg2+、Cl—、SO42—等杂质,选择装置_____________(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___________________。
(3)装置A中①的名称是_____________,进水的方向是_____________。装置B在分液时为使液体顺利滴下,应进行的具体操作是_____________。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是_____________(填写字母)。
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦d.⑤②①③④⑥⑦
问题2:由海水到氯化钠晶体的实验过程中要用到的主要装置是_____________(从给定的四种装置中选择,填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列变化:①Na2CO3→Na2SiO3,②SiO2→H2SiO3,③Na2SiO3→Na2CO3,④CaO→CaSiO3,其中不能通过一步反应实现的是
A. 只有① B. ②④ C. 只有② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH3COOH溶液逐滴加入到NaOH溶液中,至溶液为中性。此时溶液中( )
A. c(CH3COO-)=c(Na+) B. c(CH3COOH)< c(Na+)
C. c(CH3COO-)>c(Na+) D. c(CH3COO-)和c(Na+)的大小无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com