
【题目】(1)AgNO3的水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示):______________;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于_______中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(用离子方程式表示)______________。把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是________。
(3)用热的纯碱溶液洗涤餐具,原因是(用离子方程式表示)_______________________。
【答案】 酸 Ag++H2O![]() AgOH+H+ HNO3 抑制 Al3++3H2O
AgOH+H+ HNO3 抑制 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Fe2O3 CO32-+H2O
Al(OH)3(胶体)+3H+ Fe2O3 CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
【解析】本题主要考查盐类水解。
(1)AgNO3的水溶液呈酸性,原因是:Ag++H2O![]() AgOH+H+;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
AgOH+H+;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
(2)明矾可用于净水,原因是Al3++3H2O![]() Al(OH)3(胶体)+3H+。把FeCl3溶液蒸干、灼烧,溶剂水挥发,水解产物氯化氢挥发,氢氧化铁分解为氧化铁,最后得到的主要固体产物是Fe2O3。
Al(OH)3(胶体)+3H+。把FeCl3溶液蒸干、灼烧,溶剂水挥发,水解产物氯化氢挥发,氢氧化铁分解为氧化铁,最后得到的主要固体产物是Fe2O3。
(3)用热的纯碱溶液洗涤餐具,原因是CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于化学、国防、石油、纺织、冶金、食品等工业。“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。回答下列问题:
(1)浓硝酸不稳定,易分解,需要保存在棕色细口瓶,并用________(填“玻璃”或“橡胶”)塞盖好,该分解的化学方程式为_______________________。
(2)将红热的木炭投入热的浓硝酸中,看到的现象是______________________。写出该反应的化学方程式______________________________。
(3)写出氨水与稀盐酸反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车人员体内酒精含量的检测装置如图所示,下列说法不正确的是

A.该检测装置实现了将化学能转化了电能,且单位时间内通过电量越大,酒精含量越高
B.电极A 的反应:H2O+C2H5OH-4e-=CH3COOH+4H+
C.电极B 是正极,且反应后该电极区pH值减小
D.电池反应:O2 +C2H5OH = CH3COOH + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中能在溶液中大量共存是( )
A.Na+、OH-、H2PO4-、NO3-B.AlO2-、K+、CO32-、Na+
C.Al3+、Cl-、AlO2-、Na+D.Fe2+、K+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为________,Y的轨道表示式为________;
(2)ZX2的分子式是________,YX2电子式是________ ;
(3)Y与Z形成的化合物的结构式是________,该化合物中化学键的种类是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KHCO3溶液跟30.0g质量分数为24.0%的KHCO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数__________。
(2)混合后溶液的物质的量浓度________。
(3)在1000g水中需溶解___________摩尔KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
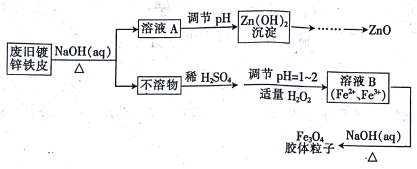
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量之比为16:7:6的三种气体SO2、CO、NO,分子数之比为_____________,氧原子数之比为_____________,相同条件下的体积之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3与CH3CH2COOCH3为同一种物质
B.C70与14C互为同素异形体
C.乙醇易溶于水,丙三醇(甘油)难溶于水
D.2,2﹣二甲基丙烷的一氯代物只有一种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com