
【题目】乙酸乙酯是一种良好的工业溶剂,可通过下列转化制取(部分反应条件略去):
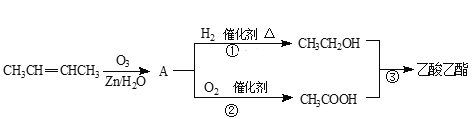
(1)CH3CH2OH中官能团的名称是______,反应②的反应类型是______。
(2)反应①是加成反应,CH3COOH的相对分子质量比A的相对分子质量大16。有机物A的结构简式是______。反应③的化学方程式是______。
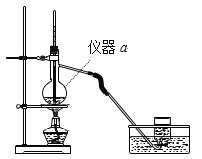
(3)实验室常用如图所示的装置制取少量乙烯(![]() )。
)。
已知:![]()
![]()
![]()
仪器a的名称是______。乙烯通常采用排水法收集而不用排空气法收集的原因是______。
(4)CH3COOH在一定条件下反应可生成一种有机物Q。该有机物Q的摩尔质量是102 g·mol-1,其中氧的质量分数为47.06%,碳氢原子个数比为2∶3。有机物Q的化学式是______。
【答案】羟基 氧化反应 CH3CHO CH3COOH +CH3CH2OH![]() CH3COOCH2CH3 +H2O 蒸馏烧瓶 乙烯难溶于水且乙烯的密度与空气的非常接近 C4H6O3
CH3COOCH2CH3 +H2O 蒸馏烧瓶 乙烯难溶于水且乙烯的密度与空气的非常接近 C4H6O3
【解析】
由题给有机物转化关系可知,CH3CH= CH CH3在锌和水的作用下,与臭氧反应生成比乙酸的相对分子质量小16的乙醛,则A为乙醛;反应生成的乙醛在催化剂作用下,与氢气共热发生加成反应生成乙醇;乙醛在催化剂作用下,与氧气发生氧化反应生成乙酸;乙醇和乙酸在浓硫酸作用下,共热发生酯化反应生成乙酸乙酯和水。
(1)CH3CH2OH的官能团为—OH,名称为羟基;反应②为乙醛在催化剂作用下,与氧气发生氧化反应生成乙酸,故答案为:羟基;氧化反应;
(2)反应①是CH3CH= CHCH3在锌和水的作用下,与臭氧反应生成比乙酸的相对分子质量小16的乙醛,乙醛的结构简式为CH3CHO;反应③为乙醇和乙酸在浓硫酸作用下,共热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3COOH +CH3CH2OH![]() CH3COOCH2CH3 +H2O,故答案为:CH3CHO;CH3COOH +CH3CH2OH
CH3COOCH2CH3 +H2O,故答案为:CH3CHO;CH3COOH +CH3CH2OH![]() CH3COOCH2CH3 +H2O;
CH3COOCH2CH3 +H2O;
(3)由实验装置图可知,仪器a为带有支管的蒸馏烧瓶;因乙烯难溶于水且乙烯的密度与空气的非常接近,所以实验室通常采用排水法收集而不用排空气法收集乙烯,故答案为:蒸馏烧瓶;乙烯难溶于水且乙烯的密度与空气的非常接近;
(4)由Q中氧的质量分数为47.06%,碳氢原子个数比为2∶3可知,Q分子中C的质量分数为47.06%,H的质量分数为5.88%,则Q分子中C原子的个数为![]() ≈4,H原子的个数为
≈4,H原子的个数为![]() ≈6,O原子的个数为
≈6,O原子的个数为![]() ≈3,则Q的分子式为,故答案为:C4H6O3。
≈3,则Q的分子式为,故答案为:C4H6O3。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有Na+、K+、HCO3-、SO32-等离子。向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是( )
A.Na+B.SO32-C.K+D.HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-1、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)硫离子的结构示意图_____________。
(2)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C![]() K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
(3)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象____________。二氧化硫呈现______________(选填“氧化性”、“还原性”)。
(4)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。
以下是二氧化硫形成酸雨的两种途径:
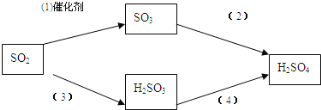
请分别写出(1)和(4)的化学方程式: ________________, ___________________。
(5)你认为减少酸雨产生的途径可采用的措施是_______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③ B. ②③④ C. ①③⑤ D. ①③④⑤
(6)硫酸盐的种类很多,且应用广泛,医疗上常用_______(写化学式)作X射线透视肠胃的内服药剂,生活用水可以用_________(写化学式)作净水剂。
(7)有化学反应2SO2(g)+O2(g)![]() 2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置______;B的原子结构示意图______;
(2)E元素形成最高价氧化物对应的水化物的化学式为______;
(3)元素C、D、E形成的原子半径大小关系是______(用元素符号表示).
(4)C、D可形成化合物D2C2,D2C2含有的化学键是______;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式______,
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在工农业生产和日常生活中有重要用途。

(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_____________(从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.冷凝管
步骤④发生反应的离子方程式为____________________________________。
(2)若步骤⑤采用裂化汽油提取碘,后果是__________________________。
(3)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为:IBr+H2O==HBr+HIO等,下列有关IBr的叙述中错误的是(____)。
A.固体溴化碘熔沸点较高
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(4)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,下列说法正确的是(____)。
A.碘易溶于有机溶剂,可用酒精萃取碘水中的I2
B.检验加碘盐原理:IO3—+5I—+3H2O ===3I2+6OH—
C.在KIO3溶液中加入几滴淀粉溶液,溶液变蓝色
D.向某无色溶液中加入氯水和四氯化碳,振荡,静置,下层呈紫色,说明原溶液中有I—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应CO2(g)+C(s)![]() 2CO(g)的△H<0,△S>0
2CO(g)的△H<0,△S>0
B. 钢铁水闸可用牺牲阳极或者外加电流的阴极保护法减缓其腐蚀
C. 常温下,KSP[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤1×10-6 mol·L-1,需调节溶液的pH≥5
D. 常温常压下,11.2 L Cl2与足量铁粉充分反应,转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是________________,其还原产物是________________;
(2)该反应的平衡常数表达式为K=___________________________________;
(3)若知上述反应为放热反应,则其反应热△H_______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= _____________________.
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是______________;图中表示平衡混合物中CO的含量最高的一段时间是____________。

(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是_________________(提示:272 =729)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com