
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、已知,N2(g)+3 H2(g)?2NH3(g)△H<0,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| D、对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |


科目:高中化学 来源: 题型:
| A、CO的燃烧热为-283 kJ/mol |
| B、在③反应时,若加入催化剂,可以使△H减小 |
| C、若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ |
| D、若生成相同质量的CO2,则放出的热量C2H2大于CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
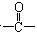 结构( )
结构( )| A、1个 |
| B、2 个 |
| C、3 个 |
| D、4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③④ |
| C、①③ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3和O2两种气体都是氧元素形成的单质,化学性质相同 |
| B、生成O3和NO的反应都是氧化还原反应 |
| C、NO在空气中不能稳定存在,会继续反应 |
| D、NO的产生是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 结论 |
| A | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 反应开始速率不相同 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | Na2S2O3溶液与稀硫酸的反应中,其他条件相同时,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
| D | 在容积可变的密闭容器中发生反应H2(g)+I2(g)?2HI(g),把容积缩小一倍 | 正反应速率加快,逆反应速率不变 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com