
【题目】(1)用系统命名法命名下列物质
①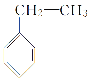 ______________;
______________;
②CH3CH2CH=CHCH3____________。
(2)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式_____________。
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称__________。
(3)![]() CH2-CH=CH-CH2
CH2-CH=CH-CH2![]() 是一种加聚产物,则其单体的结构简式为___________,其链节为______________。
是一种加聚产物,则其单体的结构简式为___________,其链节为______________。
(4)请写出分子式为 C4H8O2属于酯类的同分异构体的结构简式________。
【答案】乙苯 2-戊烯 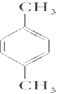 2,2-二甲基丙烷 CH2=CH-CH=CH2 -CH2-CH=CH-CH2- HCOOCH2CH2CH3、HCOOCH(CH3)CH3、CH3COOCH2CH3和CH3CH2COOCH3
2,2-二甲基丙烷 CH2=CH-CH=CH2 -CH2-CH=CH-CH2- HCOOCH2CH2CH3、HCOOCH(CH3)CH3、CH3COOCH2CH3和CH3CH2COOCH3
【解析】
(1)①以苯环为母体,侧链为乙基;②主链含5个C,双键在2号C上;据此分析书写有机物的名称;
(2)①苯环上的一溴取代物只有一种,说明苯环上只有一种氢原子;②戊烷(C5H12)的某种同分异构体只有一种一氯代物,则12个H完全相同,据此分析解答;
(3)根据加聚反应的原理分析解答;
(4)首先确定酯基,然后在酯基两端调整碳原子的数目,依次书写分子式为 C4H8O2属于酯类的同分异构体。
(1)①以苯环为母体,侧链为乙基,名称为乙苯,故答案为:乙苯;
②主链含5个C,双键在2号C上,名称为2-戊烯,故答案为:2-戊烯;
(2)①苯环上的一溴取代物只有一种,说明苯环上只有一种氢原子,则2个碳原子不可能是形成1个乙基,只能是2个甲基,且处于对位,其结构简式为 ,故答案为:
,故答案为: ;
;
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,则12个H完全相同,为C(CH3)4,名称为2,2-二甲基丙烷,故答案为:2,2-二甲基丙烷;
(3)![]() CH2-CH=CH-CH2
CH2-CH=CH-CH2![]() 是一种加聚产物,则其单体的结构简式为CH2=CH-CH=CH2,其链节为-CH2-CH=CH-CH2-,故答案为:CH2=CH-CH=CH2;-CH2-CH=CH-CH2-;
是一种加聚产物,则其单体的结构简式为CH2=CH-CH=CH2,其链节为-CH2-CH=CH-CH2-,故答案为:CH2=CH-CH=CH2;-CH2-CH=CH-CH2-;
(4)分子式为 C4H8O2属于酯类的同分异构体有:HCOOCH2CH2CH3、HCOOCH(CH3)CH3、CH3COOCH2CH3和CH3CH2COOCH3,故答案为:HCOOCH2CH2CH3、HCOOCH(CH3)CH3、CH3COOCH2CH3和CH3CH2COOCH3。


科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
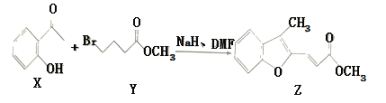
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的定容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )

A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应进行到10s后停止反应
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
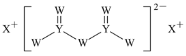
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:N2O4 ![]() 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) /mol | 0.40 | 0.28 | 0.20 | 0.14 | 0.10 | 0.10 |
n(NO2) /mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为__________。
(2)40s时,NO2的的浓度b=_________mol/L,反应最迟到________s到达平衡状态
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A. 2 v(N2O4 ) =v(NO2 ) B. 容器内压强保持不变
C. 容器内密度保持不变 D. NO2的体积分数保持不变
(6)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
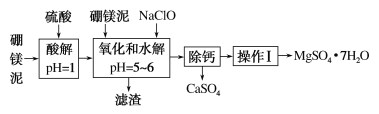
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸800 mL,若用18.4 mol·L-1的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为________。
A 10 mL B 20 mL C 50 mL D 100 mL
(2)加入的NaClO可将Mn2+氧化为MnO2,反应的离子方程式为:___________________,还有一种离子也会被NaClO氧化,反应的离子方程式为______________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有_______________。
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:____________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、________________(填操作名称)。
(6)实验中提供的硼镁泥共10 g,得到MgSO4·7H2O共17.22 g,则MgSO4·7H2O的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验
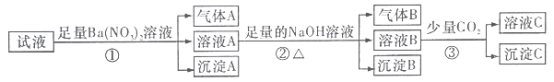
下列有关判断正确的是( )
A. 原试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中由白色迅速变成灰绿色,最终变为红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15.3 g Mg-Al合金(无其他成分),加入到500 mL稀硝酸中,恰好完全反应后,共收集到标准状况下的NO气体11.2 L,向所得溶液中加入4 mol/L NaOH溶液400 mL,得到白色沉淀。下列叙述中正确的是
A.合金中,m(Mg):m(Al)=1:1
B.原稀硝酸的物质的量浓度与NaOH溶液相同
C.白色沉淀的成分为Mg(OH)2
D.过滤后,向白色沉淀中加入原稀硝酸250 mL,可将沉淀全部溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com