
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
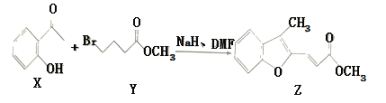
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____,有____个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____,微粒之间存在的作用力是____。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____。
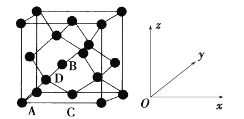
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程中H2S气体的逸出)。下列说法正确的是( )
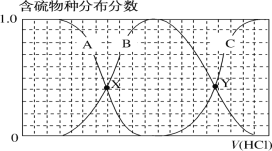
A.含硫物种B表示H2S
B.在滴加盐酸过程中,溶液中c(Na+)与含硫物种浓度的关系为c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
C.X、Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka1
D.NaHS溶液呈碱性,若向该溶液中加入CuSO4溶液,恰好完全反应时所得溶液呈强酸性,其原因是Cu2++HS-=CuS↓+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种重要的工业原料和清洁能源,可用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等。
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH= _______kJ·mol1。
CO2(g)+4H2(g) ΔH= _______kJ·mol1。
(2)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。
2NH3(g) ΔH=92.4 kJ·mol1。
①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有_______(填字母代号)。
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K__________(填“增大”“不变”或“减小”)。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L1·min1,H2的平衡转化率为_______(保留三位有效数字),则该温度下反应的平衡常数K=_______。
(3)下图所示装置工作时均与H2有关。
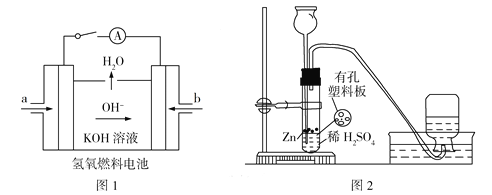
①图l所示装置,通入H2的管口是______(填字母),正极反应式为___________________。
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是_____________________,若反应装置中硫酸过量,则加入CuSO4溶液后,生成的氢气量__________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲。红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示。

下列说法正确的是
A. 红斑素和红曲素都存在2个手性碳原子
B. 一定条件下红斑素和红曲素都能发生加聚和自身的缩聚反应
C. 红斑素中含有醚键、羰基、酯键这三种含氧官能团
D. 1 mol红曲素最多能与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现,新药瑞德西韦对抗冠状病毒有效,其结构如下图,下列关于该有机物说法正确的是( )

A.不能使酸性高锰酸钾溶液褪色
B.与碱溶液反应,与酸溶液不反应
C.分子中所有碳原子一定在同一平面上
D.一定条件下,可以发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用锂离子电池般需要体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。请回答下列问题:
(1)LiCoO2、LiFePO4 常用作锂离子电池的正极材料。基态Fe原子的价电子排布式为___基态Co原子核外电子的空间运动状态有_______种。
(2)PO43-的空间构型是______,写出与其互为等电子体的一种阴离子______,基态P原子的第一电离能为什么比基态S原子的第一电离能大:______。
(3)现有化学式为Co(NH3)5Cl3的配合物,1mol 该物质最多可以与2molAgNO3反应,则该配合物中钴的配位数为______, 配体中N的杂化方式为_____,1mol 该配合物中含δ键数目为______NA。
(4)FeO是离子晶体,其晶格能可通过下图的Bom-Haber循环计算得到。气态电中性基态原子获得一个电子变为气态一价负离子放出的能量叫做第一电子亲和能,由图可知O原子的第一电子亲和能为_____kJ·mol-1, FeO晶格能为_____kJ·mol-1。

(5)单质锂晶体的结构如下图,晶胞中锂的配位数为____,晶胞的空间利用率为____(用含有n的表达式即可),若晶胞边长为a pm, NA为阿伏加德罗常数,则金属锂的密度为_____ g cm-3。(写出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组探究AgNO3与(NH4)2Fe(SO4)2的反应,实验操作和实验现象如下:

已知AgSCN为难溶于水的白色沉淀,则下列说法错误的是( )
A.试管②中产生银镜的离子方程式为Ag++Fe2+═Ag+Fe3+
B.试管②中生成的白色沉淀可能是Ag2SO4
C.若将试管③中局部变红溶液小心分离出来并向其中加入少量KCl固体,溶液的颜色会变浅甚至消失
D.试管③中,振荡后红色消失是因为Ag+与SCN-生成AgSCN,使平衡Fe3++3SCN-![]() Fe(SCN)3逆向移动
Fe(SCN)3逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名下列物质
①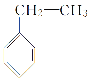 ______________;
______________;
②CH3CH2CH=CHCH3____________。
(2)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式_____________。
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称__________。
(3)![]() CH2-CH=CH-CH2
CH2-CH=CH-CH2![]() 是一种加聚产物,则其单体的结构简式为___________,其链节为______________。
是一种加聚产物,则其单体的结构简式为___________,其链节为______________。
(4)请写出分子式为 C4H8O2属于酯类的同分异构体的结构简式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com