
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____,有____个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____,微粒之间存在的作用力是____。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____。
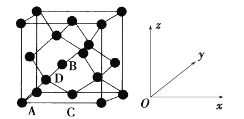
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________g·cm-3(列出计算式即可)。
【答案】3d104s24p2 2 相对分子质量的增大,范德华力增大,熔沸点升高 氧>锗>锌 sp3 共价键 (![]() ,
,![]() ,
,![]() )
) ![]() g/cm3
g/cm3
【解析】
(1)在元素周期表中,锗和硅属于同主族,锗位于硅的下一周期,即锗的原子序数为14+18=32,基态原子核外电子排布式为[Ar] 3d104s24p2;由于4p能级有3个能量相同的轨道,根据洪特规则,4p上2个电子分别占据两个轨道且自旋方向相同,因此未成对电子为2;
(2)根据表格数据得出,三种锗卤化物都是分子晶体,不含分子间氢键,因此熔沸点随着相对分子质量的增大,范德华力增大,熔沸点升高;
(3)锌、锗位于同周期,同一周期从左向右元素的电负性逐渐增大,而氧位于元素周期表右上角,电负性仅次于F,得出三种元素的电负性大小顺序是氧>锗>锌;
(4)类比金刚石,晶体锗属于原子晶体,每个锗与其周围的4个锗原子形成4个单键,锗原子的杂化类型为sp3,微粒间的作用力是共价键;
(5)①对照晶胞图示,坐标系以及A、B、C点坐标,选A点为参照点,观察D点在晶胞中位置,即体对角线的![]() ,D的坐标参数为(
,D的坐标参数为(![]() ,
,![]() ,
,![]() );
);
②类似金刚石晶胞,1个晶胞含有8个锗原子,即晶胞的质量为![]() ,晶胞的体积为(a×10-10)3cm3,即晶胞的密度为
,晶胞的体积为(a×10-10)3cm3,即晶胞的密度为![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是 ( )
A.向![]() 溶液中加入等浓度等体积的盐酸:
溶液中加入等浓度等体积的盐酸:![]() =
=![]() +
+![]()
![]()
B.![]() 溶液中:
溶液中:![]()
C.pH相同的①![]() 溶液、②
溶液、②![]() 溶液中
溶液中![]() :①<②
:①<②
D.pH=9的![]() 的
的![]() 的溶液中:
的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为_______、_________、_________。
(2)有机物A的结构简式为
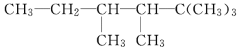
①用系统命名法命名A:___________________________
②若A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构。写出A的该种同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷燃烧热为890.3 kJmol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJmolˉ1
C.H2燃烧热为285.8kJmolˉ1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJmolˉ1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置符合实验目的是( )
目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
装置 |
|
|
|
|
选项 | A | B | C | D |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液中存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示![]() 或
或![]() 与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是
与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是

A.曲线I表示lg![]() 与pH的变化关系
与pH的变化关系
B.a→b的过程中,水的电离程度逐渐减小
C.当pH增大时,![]() 逐渐减小
逐渐减小
D.当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,物质之间通过一步反应就能实现如图所示变化的是( )
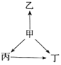
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
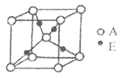
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
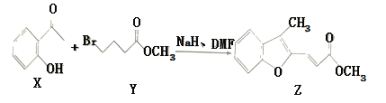
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com