
【题目】(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为_______、_________、_________。
(2)有机物A的结构简式为
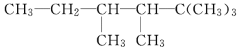
①用系统命名法命名A:___________________________
②若A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构。写出A的该种同分异构体的结构简式_______。
【答案】C5H10 

 2,2,3,4-四甲基己烷 (CH3)3C-CH2-CH2-C(CH3)3
2,2,3,4-四甲基己烷 (CH3)3C-CH2-CH2-C(CH3)3
【解析】
(1)烯烃为CnH2n,则12n+2n=70,解得n=5;根据该烯烃与氢气加成后得到的烷烃分子中含3个甲基解题;
(2)①依据系统命名法原则命名;
②由A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型可知,烯烃中有2个无氢碳分别连在2个不饱和碳原子上。
(1)烯烃为CnH2n,则12n+2n=70,解得n=5,分子式为C5H10;若该烯烃与氢气加成后得到的烷烃分子中含4个甲基,可能的结构简式:CH2=CCH3CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2,故答案为:C5H10;CH2=CCH3CH2CH3、CH3)2C=CHCH3、(CH3)2CHCH=CH2;
(2)① 分子中最长碳链含有6个碳原子,含有4个甲基,名称为2,2,3,4-四甲基己烷,故答案为:2,2,3,4-四甲基己烷;
分子中最长碳链含有6个碳原子,含有4个甲基,名称为2,2,3,4-四甲基己烷,故答案为:2,2,3,4-四甲基己烷;
②由A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型可知,烯烃中有2个无氢碳分别连在2个不饱和碳原子上,烯烃的结构简式为(CH3)3C-CH=CH-C(CH3)3,则A的同分异构体的结构简式为(CH3)3C-CH2-CH2-C(CH3)3,故答案为:(CH3)3C-CH2-CH2-C(CH3)3。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点390℃,沸点430℃,易与水反应,可用锂与氨气加热反应制得。下面是实验室制备LiNH2时可能用到的装置图,回答下列问题:
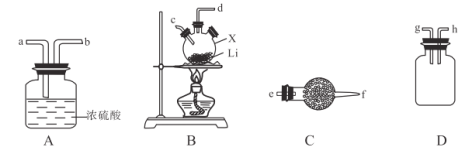
(1)仅从性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填字母)。
A.浓氨水、Ca(OH)2固体 B.浓氨水、CaO C.NH4Cl固体、Ca(OH)2固体
(2)选用(1)中适宜药品制取出的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处字母)。
(3)装置A的作用是_______________________。
(4)实验开始时,应先通入NH3后加热仪器X,原因是____________________。
(5)氨基锂能与水反应生成LiOH与一种气体,请设计实验证明制备的LiNH2中是否含有金属锂。_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烯醛是一种重要的有机合成中间体,沸点为177℃,密度为0.848 g·cm-3,不溶于水。实验室采用正丁醛制各少量辛烯醛,反应原理为:
CH3CH2CH2CHO![]()

![]()
![]()
实验步骤如下:
步骤Ⅰ:向三颈烧瓶中加入6.3 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入5mL正丁醛。
步骤Ⅱ:充分反应后,将反应液倒入如图仪器中,分去碱液,将有机相用蒸馏水洗至中性。

步骤Ⅲ:经洗涤的有机相加入适量无水硫酸钠固体,放置一段时间后过滤。
步骤Ⅳ:减压蒸馏有机相,收集60~70℃/1.33~4.00kPa的馏分。
(l)步骤Ⅰ中的反应需在80℃条件下进行,适宜的加热方式为___ 。使用冷凝管的目的是 _______。
(2)步骤Ⅱ中所用仪器的名称为_____ 。碱液在仪器中处于_____(填“上层”或“下层”),如何判断有机相已经洗至中性:______。
(3)步骤Ⅲ中加入无水硫酸钠固体的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,请回答下列有关问题:
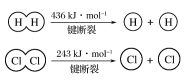
①由H+H→H2,当形成1 mol H—H键时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl—Cl键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
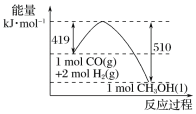
(2)①根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”) ________kJ能量。
②1mol CO(g)的总键能_______(填“>”、“=”或“<”)1mol CH3OH(l)的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____,有____个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____,微粒之间存在的作用力是____。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____。
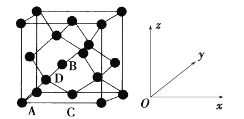
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程中H2S气体的逸出)。下列说法正确的是( )
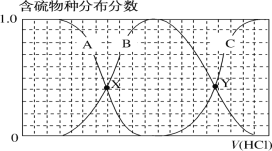
A.含硫物种B表示H2S
B.在滴加盐酸过程中,溶液中c(Na+)与含硫物种浓度的关系为c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
C.X、Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka1
D.NaHS溶液呈碱性,若向该溶液中加入CuSO4溶液,恰好完全反应时所得溶液呈强酸性,其原因是Cu2++HS-=CuS↓+H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com