
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程中H2S气体的逸出)。下列说法正确的是( )
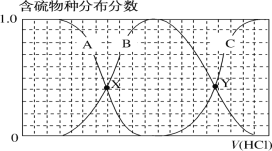
A.含硫物种B表示H2S
B.在滴加盐酸过程中,溶液中c(Na+)与含硫物种浓度的关系为c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
C.X、Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka1
D.NaHS溶液呈碱性,若向该溶液中加入CuSO4溶液,恰好完全反应时所得溶液呈强酸性,其原因是Cu2++HS-=CuS↓+H+
【答案】D
【解析】
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小,则A为S2-;B先增加后减少,则B为HS-;C开始时几乎不存在,之后逐渐增大,则C为H2S。
A.B先增加后减少,则B为HS-;C开始时几乎不存在,之后逐渐增大,则C为H2S,故A错误;
B.向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,若忽略滴加过程H2S气体的逸出,根据混合液Na、S物料守恒可得:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],故B错误;
C.X点为S2-和HS-浓度相同,K2(H2S)=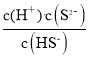 =c(H+),则由X点处的pH,可计算Ka2(H2S)的值,故C错误;
=c(H+),则由X点处的pH,可计算Ka2(H2S)的值,故C错误;
D.NaHS溶液中加入CuSO4溶液,硫化铜难溶于稀酸,发生反应:Cu2++HS-=CuS↓+H+,溶液显示强酸性,故D正确;
故选D。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为_______、_________、_________。
(2)有机物A的结构简式为
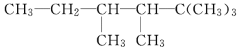
①用系统命名法命名A:___________________________
②若A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构。写出A的该种同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,物质之间通过一步反应就能实现如图所示变化的是( )
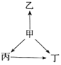
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
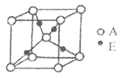
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种新型高分子材料的结构简式如图,对此高聚物叙述正确的是( )
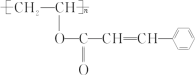
A.化学式为(C11H11O2)n
B.可以发生水解反应、氧化反应,不能发生取代反应
C.1mol该有机物分子最多能和4molH2发生加成反应
D.该高分子材料是由两种单体经酯化后加聚而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应后的终止温度
B. HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C. 燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D. S(s)+ ![]() O2(g)
O2(g)![]() SO3(g) ΔH=315 kJ·mol1(燃烧热)
SO3(g) ΔH=315 kJ·mol1(燃烧热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在25℃、101kPa时,H2与O2化合生成1molH2O(g)放出241.8kJ的热量,其热化学方程式为______.
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJ/mol
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g)△H=______kJ/mol.
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
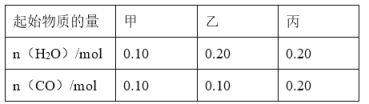
①该反应的平衡常数表达式为______.
②平衡时,甲容器中CO的转化率是______;容器中CO的转化率:乙______甲;丙______甲.(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度______(填“升高”或“降低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
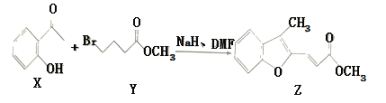
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的定容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )

A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应进行到10s后停止反应
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com