
【题目】常温下,下列说法正确的是 ( )
A.向![]() 溶液中加入等浓度等体积的盐酸:
溶液中加入等浓度等体积的盐酸:![]() =
=![]() +
+![]()
![]()
B.![]() 溶液中:
溶液中:![]()
C.pH相同的①![]() 溶液、②
溶液、②![]() 溶液中
溶液中![]() :①<②
:①<②
D.pH=9的![]() 的
的![]() 的溶液中:
的溶液中:![]()
【答案】B
【解析】
A.碳酸钠溶液中加入等浓度等体积的盐酸反应生成碳酸氢钠溶液和氯化钠溶液,根据物料守恒,n(Na)=n(C)+n(Cl),c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)+c(Cl-),故A错误;
B.![]() 溶液中存在电荷守恒:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),存在物料守恒:c(Na+)=c(H2S)+c(HS-)+c(S2-),所以有c(S2-)+c(OH-)=c(H+)+c(H2S),故B正确;
溶液中存在电荷守恒:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),存在物料守恒:c(Na+)=c(H2S)+c(HS-)+c(S2-),所以有c(S2-)+c(OH-)=c(H+)+c(H2S),故B正确;
C.次氯酸根离子的水解程度大于醋酸根离子的水解程度,pH相同的①CH3COONa溶液、②NaClO溶液,溶液的浓度①>②,因此pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①>②,故C错误;
D.pH=9的0.1molL-1的NaHR溶液显碱性,说明HR-的水解程度大于HR-的电离程度,溶液中:c(H2R)>c(R2-),故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】用酸性KMnO4溶液与H2C2O4(草酸)溶液反应研究影响反应速率的因素,一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图所示:
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |

(1)写出该反应的离子方程式__________________________________________。
(2)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是______>______(填实验序号)。
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=______ mol·L-1(假设混合溶液的体积为50mL)。
(4)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_________________________来比较化学反应速率。
(5)小组同学发现反应速率变化如图,其中t1-t2时间内速率变快的主要原因可能是:①反应放热,②___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)![]() 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
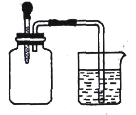
【题目】如图所示,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是 ( )
①H2、O2 ②Cl2、SO2
③NO2、O2 ④N2、H2
A.①②③B.②④
C.③④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。

请回答下列问题:
(1)通过试管乙中发生的____现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有______性。
(2)若要收集试管甲中生成的气体,可以采用_________方法收集(填序号)。
①排水取气法 ② 向上排空气取气法 ③ 向下排空气取气法
(3)写出试管甲中所发生反应的化学反应方程式__________。
(4)试管乙口部浸有碱液的棉花的作用是__________,此防范措施也说明产生的气体是 ______气体(填“酸性”、“中性”或“碱性”),_______(填“有”或“无”)毒性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点390℃,沸点430℃,易与水反应,可用锂与氨气加热反应制得。下面是实验室制备LiNH2时可能用到的装置图,回答下列问题:
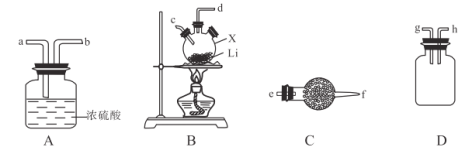
(1)仅从性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填字母)。
A.浓氨水、Ca(OH)2固体 B.浓氨水、CaO C.NH4Cl固体、Ca(OH)2固体
(2)选用(1)中适宜药品制取出的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处字母)。
(3)装置A的作用是_______________________。
(4)实验开始时,应先通入NH3后加热仪器X,原因是____________________。
(5)氨基锂能与水反应生成LiOH与一种气体,请设计实验证明制备的LiNH2中是否含有金属锂。_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烯醛是一种重要的有机合成中间体,沸点为177℃,密度为0.848 g·cm-3,不溶于水。实验室采用正丁醛制各少量辛烯醛,反应原理为:
CH3CH2CH2CHO![]()

![]()
![]()
实验步骤如下:
步骤Ⅰ:向三颈烧瓶中加入6.3 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入5mL正丁醛。
步骤Ⅱ:充分反应后,将反应液倒入如图仪器中,分去碱液,将有机相用蒸馏水洗至中性。

步骤Ⅲ:经洗涤的有机相加入适量无水硫酸钠固体,放置一段时间后过滤。
步骤Ⅳ:减压蒸馏有机相,收集60~70℃/1.33~4.00kPa的馏分。
(l)步骤Ⅰ中的反应需在80℃条件下进行,适宜的加热方式为___ 。使用冷凝管的目的是 _______。
(2)步骤Ⅱ中所用仪器的名称为_____ 。碱液在仪器中处于_____(填“上层”或“下层”),如何判断有机相已经洗至中性:______。
(3)步骤Ⅲ中加入无水硫酸钠固体的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____,有____个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____,微粒之间存在的作用力是____。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____。
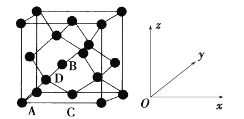
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com