
【题目】人体血液中存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示![]() 或
或![]() 与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是
与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是

A.曲线I表示lg![]() 与pH的变化关系
与pH的变化关系
B.a→b的过程中,水的电离程度逐渐减小
C.当pH增大时,![]() 逐渐减小
逐渐减小
D.当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-)
【答案】C
【解析】
H2CO3HCO3-+H+的电离平衡常数Kal=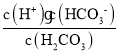 ,所以lg
,所以lg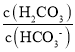 =pKal-pH=6.4-pH,H2PO4-HPO42-+H+的电离平衡常数Ka2=
=pKal-pH=6.4-pH,H2PO4-HPO42-+H+的电离平衡常数Ka2= ,所以lg
,所以lg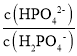 =pH-pKa2=pH-7.2,结合分析解答;
=pH-pKa2=pH-7.2,结合分析解答;
A.当lgx=0时,pH分别为6.4、7.2,所以,曲线I表示lg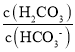 与pH的变化关系,曲线II表示lg
与pH的变化关系,曲线II表示lg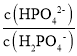 与pH的变化关系,故A错误;
与pH的变化关系,故A错误;
B.酸对水的电离有抑制作用,酸性越强即pH越小,抑制作用越大,水的电离程度越小,a→b的过程中pH增大,溶液酸性减弱,水的电离程度增大,故B错误;
C.![]() ,当pH增大时,则H2CO3HCO3+H+正向进行,使c(H2CO3)减小,而Ka1、Ka2不变,所以pH增大时,
,当pH增大时,则H2CO3HCO3+H+正向进行,使c(H2CO3)减小,而Ka1、Ka2不变,所以pH增大时,![]() 逐渐减小,故C正确
逐渐减小,故C正确
D.当c(H2CO3)=c(HCO3-)时,即lg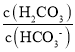 =0,溶液中pH=6.4,则lg
=0,溶液中pH=6.4,则lg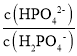 =pHpKa2=pH7.2=6.47.2=0.8<0,即c(HPO42-)<c(H2PO4-),故D错误;
=pHpKa2=pH7.2=6.47.2=0.8<0,即c(HPO42-)<c(H2PO4-),故D错误;
答案选C。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。

请回答下列问题:
(1)通过试管乙中发生的____现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有______性。
(2)若要收集试管甲中生成的气体,可以采用_________方法收集(填序号)。
①排水取气法 ② 向上排空气取气法 ③ 向下排空气取气法
(3)写出试管甲中所发生反应的化学反应方程式__________。
(4)试管乙口部浸有碱液的棉花的作用是__________,此防范措施也说明产生的气体是 ______气体(填“酸性”、“中性”或“碱性”),_______(填“有”或“无”)毒性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____,有____个未成对电子。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____,微粒之间存在的作用力是____。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为____。
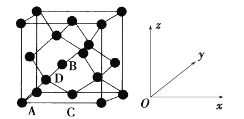
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a pm,其密度为_________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
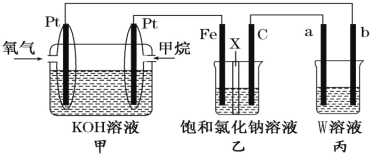
(1)石墨电极(C)作_________极,若丙池中W为Na2SO4溶液并滴有酚酞,实验开始后观察到的现象是________甲中甲烷燃料电池的负极反应式为___________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为_________ L。
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是__________________。
A.b电极为粗铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将__________________,(填“增大”“减小”或“不变”),且变化了__________________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:
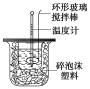
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__________
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒上下轻轻地抽动
(3)实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①根据表中数据计算出来温度差的平均值为______℃;
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_______( 取小数点后一位)。
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是____。
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极)。下列说法正确的是( )

A.Ag电极是正极,反应后该电极区溶液pH减小
B.原电池的总反应为:2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O
C.每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
D.a电极上的电极反应为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现,新药瑞德西韦对抗冠状病毒有效,其结构如下图,下列关于该有机物说法正确的是( )

A.不能使酸性高锰酸钾溶液褪色
B.与碱溶液反应,与酸溶液不反应
C.分子中所有碳原子一定在同一平面上
D.一定条件下,可以发生取代、加成和氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com