
【题目】某化学实验小组探究AgNO3与(NH4)2Fe(SO4)2的反应,实验操作和实验现象如下:

已知AgSCN为难溶于水的白色沉淀,则下列说法错误的是( )
A.试管②中产生银镜的离子方程式为Ag++Fe2+═Ag+Fe3+
B.试管②中生成的白色沉淀可能是Ag2SO4
C.若将试管③中局部变红溶液小心分离出来并向其中加入少量KCl固体,溶液的颜色会变浅甚至消失
D.试管③中,振荡后红色消失是因为Ag+与SCN-生成AgSCN,使平衡Fe3++3SCN-![]() Fe(SCN)3逆向移动
Fe(SCN)3逆向移动
【答案】C
【解析】
A. 根据氧化还原反应原理,试管②中产生银镜的离子方程式为Ag++Fe2+═Ag+Fe3+,故A正确;
B. Ag2SO4微溶于水,AgNO3与(NH4)2Fe(SO4)2反应能生成Ag2SO4沉淀,所以试管②中生成的白色沉淀可能是Ag2SO4,故B正确;
C. 向红色溶液中加入少量KCl固体,对平衡Fe 3+ + 3SCN ![]() Fe(SCN) 3 无影响,溶液的颜色不变,故C错误;
Fe(SCN) 3 无影响,溶液的颜色不变,故C错误;
D. AgSCN为难溶于水的白色沉淀,由试管①中AgNO3与(NH4)2Fe(SO4)2 的量可知Ag + 过量,故试管③中振荡后红色消失的原因是Ag +与SCN反应生成AgSCN,使平衡Fe 3+ + 3SCN ![]() Fe(SCN) 3 逆向移动,故D正确;
Fe(SCN) 3 逆向移动,故D正确;
选C。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
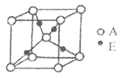
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
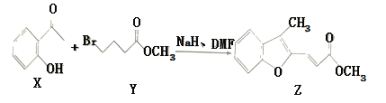
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
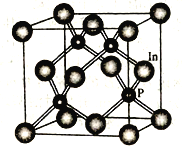
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NO2+CO=NO+CO2的能量变化如图所示,下列说法正确的是( )
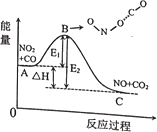
A.正反应是吸热反应
B.E1表示逆反应的活化能
C.当NO2和CO系统的平均能量到达B处时,碰撞形成ONO…CO
D.A点表示NO2和CO系统的平均能量,此处两分子发生碰撞并发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的定容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )

A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应进行到10s后停止反应
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验
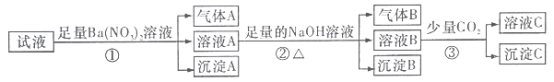
下列有关判断正确的是( )
A. 原试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中由白色迅速变成灰绿色,最终变为红褐色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com