��2011?��ͬģ�⣩���û�ѧ��Ӧԭ���о��������ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮
��1������������SO
2����������SO
3��2SO
2��g��+O
2��g��?2SO
3��g���������ϵ��SO
3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺

��2SO
2��g��+O
2��g��?2SO
3��g���ġ�H
��
��
0������������������ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ��
����
����
�ƶ�������������ҡ���������
�����¶�ΪT
1��T
2����Ӧ��ƽ�ⳣ���ֱ�ΪK
1��K
2����K
1��
��
K
2������Ӧ���е�״̬Dʱ��v
����
��
v
�������������������=����
��2�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
����ͼ��һ�����¶Ⱥ�ѹǿ����N
2��H
2��Ӧ����1molNH
3�����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ��Ӧ����ʽ��
N2��g��+3H2��g��?2NH3��g����H=-2��b-a��kJ?mol-1
N2��g��+3H2��g��?2NH3��g����H=-2��b-a��kJ?mol-1
������H����ֵ�ú���ĸa��b�Ĵ���ʽ��ʾ��
�ڰ�������ˮ�õ���ˮ����25���£���a mol?L
-1�İ�ˮ��b mol?L
-1������������ϣ���Ӧ����Һ�������ԣ���c��NH
+4��
=
=
c��Cl
-�������������������=�������ú�a��b�Ĵ���ʽ��ʾ����ˮ�ĵ���ƽ�ⳣ������ʽ
��
��3����ˮ�к��д�����Ԫ�أ�����Ԫ�����ȡ���Ԫ������ں�ˮ�о��Ի���̬���ڣ���25���£���0.1mol?L
-1��NaCl��Һ����μ���������0.1mol?L
-1��������Һ���а�ɫ�������ɣ��ӳ����ܽ�ƽ��ĽǶȽ��Ͳ���������ԭ����
���ӻ�Qc�����ܶȻ�Ksp��AgCl��
���ӻ�Qc�����ܶȻ�Ksp��AgCl��
����Ӧ�����Һ�У���������0.1mol?L
-1��NaI��Һ��������������
��ɫ����ת��Ϊ��ɫ����
��ɫ����ת��Ϊ��ɫ����
�������������ԭ���ǣ������ӷ���ʽ��ʾ��
AgCl��s��+I-�TAgI��s��+Cl-
AgCl��s��+I-�TAgI��s��+Cl-
��
����֪25��CʱK
sp[AgCl]=1.0��10
-14mol
2?L
-2��K
sp[AgI]=1.5��10
-16mol
2?L
-2��

 2NH3��g��
2NH3��g�� [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+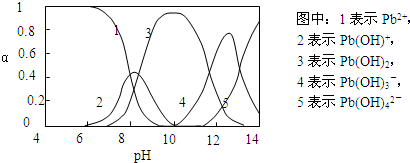
 [N2H5?H2O]++H+���ʴ�Ϊ��N2H62++H2O
[N2H5?H2O]++H+���ʴ�Ϊ��N2H62++H2O [N2H5?H2O]++H+��
[N2H5?H2O]++H+�� 

 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д� ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���ã�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���ã�
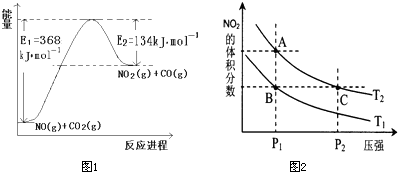
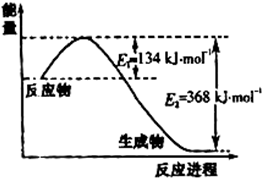 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش�