
【题目】CuCl晶体呈白色,见光易分解,在潮湿空气中易被氧化,难溶于水、稀盐酸和乙醇。实验室用如图所示装置制取CuCl。以下说法正确的是( )

A.装置A中发生的反应是氧化还原反应
B.装置B中的搅拌子是由铁直接铸造
C.装置B中反生反应的离子方程式是SO2+2Cu2++2Cl-+2H2O=2CuCl↓+4H++SO42-
D.装置C中用干燥管替代导管的主要目的是使剩余的SO2能被充分吸收
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
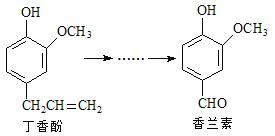
有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是 Zn 和 Cu 形成的原电池,其实兴趣小组做完实验后,在读书卡片上记下结论。其中正确的一组是( )
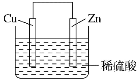
①Zn 为正极,Cu 为负极 ②H+向负极移动 ③电子是由 Zn 经外电路流向 Cu ④Cu 极上有 H2 产生 ⑤若有 1 mol 电子流过导线,则产生的 H2 为 0.5 mol ⑥正极的电极反应式为 Zn-2e-=Zn2+
A.①②③B.④⑤⑥
C.③④⑤D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_______;正极的电极反应式为____________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,则负极的电极反应式为_____________________;
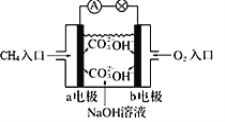
②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O,铅蓄电池负极的电极反应式为_____;充电时,铅蓄电池的PbO2极应与外加直流电源的____极相连。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应物质)时,以硫酸铜溶液为电解质溶液,粗铜做____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 相同温度时,气体分子间的距离一定相等
B. 2gH2和2gO2能恰好反应生成4gH2O
C. 3.2gO3中含有的氧原子数为1.204×1023个
D. 1 mol·L-1 MgCl2溶液中含Cl-数为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.0.5molO3的质量为16.0g
B.2molH2SO4的摩尔质量为196gmol-1
C.NO的摩尔质量与相对分子质量相等
D.40gNaOH溶于水配成1L溶液,则c(NaOH)=1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置。
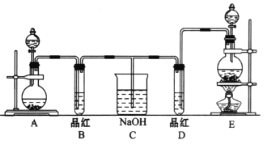
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用图中A、E两发生装置中___装置(填装置序号)制Cl2。在制Cl2的反应中浓盐酸所表现出的性质是___。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:___D:___。
(3)装置C的作用是____。
(4)甲乙两名同学分别利用如图所示装置探究两种气体按不同比例混合后的漂白性,试
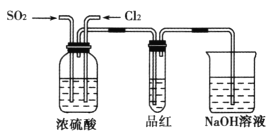
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是___。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色写出其相应的离子方程式:___。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅。其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.已知:HI(g)![]() 1/2H2(g)+1/2I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量
1/2H2(g)+1/2I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量
B.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol
C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+ O2(g)=2H2O2(l)△H=+108.3kJ/mol①N2H4(l) + O2(g)=N2(g) + 2H2O(g)△H=-534.0kJ/mol②。则有反应:N2H4(l) + 2H2O2(l) =N2(g)+ 4H2O(l)△H=-642.3kJ/mol
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com