
【题目】CH3COONa稀溶液中分别改变如下条件,能使比值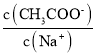 一定减小的是
一定减小的是
①固体NaOH;②少量冰醋酸;③固体NaHSO4;④固体CH3COONa;⑤降温;
A.①③B.①④C.②⑤D.③④
【答案】A
【解析】
醋酸钠溶液中存在醋酸根离子水解平衡:CH3COO-+H2OCH3COOH+OH-,使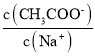 比值减小,可使平衡向正反应方向移动,结合影响水解平衡移动的因素解答该题。
比值减小,可使平衡向正反应方向移动,结合影响水解平衡移动的因素解答该题。
①加入固体NaOH,c(Na+)与c(CH3COO)都增大,但c(Na+)增大幅度较大, 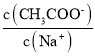 比值减小,故①符合;
比值减小,故①符合;
②加入冰醋酸,c(CH3COO)增大,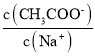 增大,故②不符合;
增大,故②不符合;
③加入固体NaHSO4,平衡向正向移动,c(Na+)增大,c(CH3COO-)减小,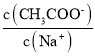 一定减小,故③符合;
一定减小,故③符合;
④加入固体CH3COONa,浓度增大,水解程度降低,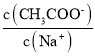 一定增大,故④不符合;
一定增大,故④不符合;
⑤水解平衡时吸热反应,降温,平衡逆向进行,醋酸根离子浓度增大,则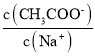 比值增大,故⑤不符合。
比值增大,故⑤不符合。
答案选A。


科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)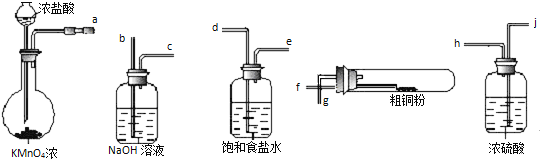
①按气流方向连接各仪器接口顺序是:![]() ______ .
______ .
②反应时,盛粗铜粉的试管中的现象是 ______ .
③已知:氯化铜溶液中有如下转化关系:
![]()
![]()
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 ______ ![]() 填序号
填序号![]() .
.
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入![]() 晶体,溶液变为绿色
晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列过程与氧化还原反应无关的是( )
A.酸性重铬酸钾用于检测酒精
B.铝粉与强碱溶液反应放热
C.植物油在空气中变质,产生“哈喇”味
D.海水经风吹日晒获得粗盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是
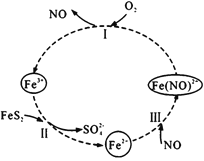
A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ш是氧化还原反应
D.黄铁矿催化氧化中NO作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
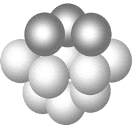
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
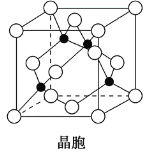
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如下。
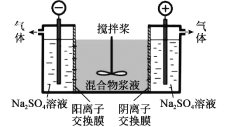
下列说法不正确的是( )
A.阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
B.CrO42-通过阴离子交换膜进入阳极室,从而实现与浆液的分离
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.适当增大电压,CrO42-也可在阴极室转化为Cr(OH)3除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
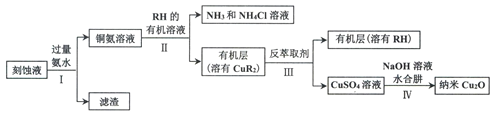
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列计算:
(1)25℃,0.1mol/L NaOH溶液中的c(H+)=________,稀释该溶液到原体积的100倍,水电离出的c(OH-)的浓度为__________________;
(2)25℃,pH=13的NaOH溶液中的c(OH-)是pH=11的NaOH溶液中的c(OH-)的______倍,将这两种NaOH溶液等体积混合后的溶液pH为___________(lg2≈0.3,lg3≈0.5,lg5≈0.7,忽略溶液体积变化);
(3)25℃,等物质的量浓度的NaOH溶液与盐酸按3:2体积比混合,所得溶液的pH为12,则NaOH溶液与盐酸的初始浓度为________________(忽略溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com