
【题目】用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)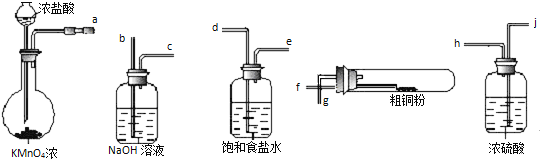
①按气流方向连接各仪器接口顺序是:![]() ______ .
______ .
②反应时,盛粗铜粉的试管中的现象是 ______ .
③已知:氯化铜溶液中有如下转化关系:
![]()
![]()
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 ______ ![]() 填序号
填序号![]() .
.
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入![]() 晶体,溶液变为绿色
晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.
【答案】![]() 铜粉逐渐减少并生成大量棕黄色的烟 ABC
铜粉逐渐减少并生成大量棕黄色的烟 ABC
【解析】
![]() 要制备收集纯净的氯气应该除去氯气中的杂质
要制备收集纯净的氯气应该除去氯气中的杂质![]() 水、
水、![]() ,除氯化氢用饱和食盐水,除去水用浓硫酸,然后与铜反应,最后尾气处理用氢氧化钠,据此解答;
,除氯化氢用饱和食盐水,除去水用浓硫酸,然后与铜反应,最后尾气处理用氢氧化钠,据此解答;
![]() 粗铜粉与氯气反应生成棕黄色的氯化铜;
粗铜粉与氯气反应生成棕黄色的氯化铜;
![]() 根据勒夏特列原理,通过改变浓度使平衡发生移动从而使溶液颜色发生改变,即可证明溶液中有
根据勒夏特列原理,通过改变浓度使平衡发生移动从而使溶液颜色发生改变,即可证明溶液中有![]()
![]() 的转化关系。
的转化关系。
![]() 从a出来的气体含有氯化氢和水蒸气,依次通过dejh除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过fgbc,所以按照气流方向各仪器接口的连接顺序为
从a出来的气体含有氯化氢和水蒸气,依次通过dejh除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过fgbc,所以按照气流方向各仪器接口的连接顺序为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟,故答案为:铜粉逐渐减少并生成大量棕黄色的烟;
粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟,故答案为:铜粉逐渐减少并生成大量棕黄色的烟;
![]() 将Y稀释,平衡向左移动,溶液呈蓝色,可以能够证明
将Y稀释,平衡向左移动,溶液呈蓝色,可以能够证明![]() 溶液中转化关系,故A正确;
溶液中转化关系,故A正确;
B.在Y中加入![]() 晶体,溶液中
晶体,溶液中![]() 浓度增大,平衡向右移动,溶液变为绿色,可以能够证明
浓度增大,平衡向右移动,溶液变为绿色,可以能够证明![]() 溶液中转化关系,故B正确;
溶液中转化关系,故B正确;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明![]() 溶液中转化关系,故C正确;
溶液中转化关系,故C正确;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明![]() 溶液中转化关系,故D错误。
溶液中转化关系,故D错误。
故答案为:ABC。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写中,正确的是( )
A.氯化铁溶液吸收H2S:S2-+2Fe3+=2Fe2++S↓
B.用氢氧化钠溶液吸收氯气:Cl2+2OH-=ClO-+Cl-+H2O
C.将少量SO2通入NaClO溶液:SO2+H2O+2ClO-=SO32-+2HClO
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?) ![]() 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表中前四周期的元素,原子序数依次增大。A、C原子2p能级上均有两个未成对电子,EC2与BC2-为等电子体,D基态原子有11种运动状态的电子,F是第四周期未成对电子最多的原子。请回答下列问题:
(1)上述元素中第一电离能最大的是__(填元素符号)。A基态原子的电子排布式是__,E在周期表中的位置是第__周期__族。
(2)科学家成功地在高压下将AC2转化为具有空间立体网状结构的晶体,该晶体中A的杂化轨道类型是__。
(3)D+、AB-、F6+三种离子组成的化合物D3F(AB)6,其中化学键的类型有__,该化合物中存在一个复杂离子,该离子的化学式为__。
(4)“酒精检测仪”中有红色FC3和少量H2SO4,检测酒驾时反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,三个体积均为1L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | ||||
CH4 | NO2 | N2 | CO2 | H2O | NO2 | ||
I | T1 | 0.50 | 1.2 | 0 | 0 | 0 | 0.40 |
II | T2 | 0.30 | 0.80 | 0.20 | 0.20 | 0.40 | 0.60 |
III | T3 | 0.40 | 0.70 | 0.70 | 0.70 | 1.0 | |
A.T1<T2
B.若升高温度,正反应速率减小,逆反应速率增大,平衡逆移
C.平衡时,容器I中反应放出的热量为693.6 kJ
D.容器III中反应起始时v 正(CH4) <v逆(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:
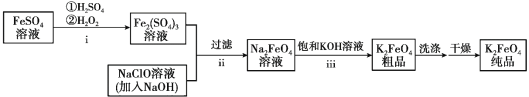
①i中反应的离子方程式是_______。
② 将ii中反应的离子方程式补充完整:____Fe3+ +____OH- +____ClO-=____FeO42-+_______+________
③ iii中反应说明溶解度:Na2FeO4_______K2FeO4(填“>”或“< ”)。
(2)K2FeO4的性质:
i. 将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii. 将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii. 将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
① K2FeO4溶于蒸馏水的化学反应方程式是_______。
② K2FeO4的氧化性与溶液pH的关系是_______。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:
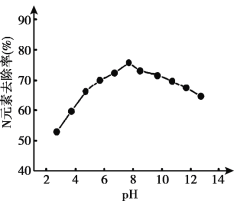
① K2FeO4脱氮的最佳pH是_____。
② 根据图推测,pH = 4时生活垃圾渗透液中含氮物质主要以______形式存在。
③ pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COONa稀溶液中分别改变如下条件,能使比值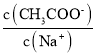 一定减小的是
一定减小的是
①固体NaOH;②少量冰醋酸;③固体NaHSO4;④固体CH3COONa;⑤降温;
A.①③B.①④C.②⑤D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯取代物的数目分别是( )
A.2个甲基,能生成4种一氯代物 B.4个甲基,能生成1种一氯代物
C.3个甲基,能生成5种一氯代物 D.4个甲基,能生成4种一氯代物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com