
【题目】A、B、C、D、E、F为元素周期表中前四周期的元素,原子序数依次增大。A、C原子2p能级上均有两个未成对电子,EC2与BC2-为等电子体,D基态原子有11种运动状态的电子,F是第四周期未成对电子最多的原子。请回答下列问题:
(1)上述元素中第一电离能最大的是__(填元素符号)。A基态原子的电子排布式是__,E在周期表中的位置是第__周期__族。
(2)科学家成功地在高压下将AC2转化为具有空间立体网状结构的晶体,该晶体中A的杂化轨道类型是__。
(3)D+、AB-、F6+三种离子组成的化合物D3F(AB)6,其中化学键的类型有__,该化合物中存在一个复杂离子,该离子的化学式为__。
(4)“酒精检测仪”中有红色FC3和少量H2SO4,检测酒驾时反应的化学方程式为___。
【答案】N 1s22s22p2 三 VIA sp3 离子键、配位键、共价键 [Cr(CN)6]3- C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O
【解析】
A、B、C、D、E、F为元素周期表中前四周期的元素,原子序数依次增大。A、C原子2p能级上均有两个未成对电子,外围电子排布分别为![]() 、
、![]() ,则A为碳元素,C为O元素,B的原子序数介于碳、氧之间,则B为N元素;D基态原子有11种运动状态的电子,则D为Na;F是第四周期未成对电子最多的原子,外围电子排布式为
,则A为碳元素,C为O元素,B的原子序数介于碳、氧之间,则B为N元素;D基态原子有11种运动状态的电子,则D为Na;F是第四周期未成对电子最多的原子,外围电子排布式为![]() ,则F为Cr;
,则F为Cr;![]() 与
与![]() 为等电子体,结合原子序数可知E为S元素。
为等电子体,结合原子序数可知E为S元素。
(1)非金属性越强,第一电离能越大,氮元素2p轨道为半满稳定状态,能量较低,第一电离能高于氧元素,故上述元素中第一电离能最大的是N;A为碳元素,基态原子的电子排布式是![]() ,E为S元素,在周期表中的位置是第三周期VIA族,
,E为S元素,在周期表中的位置是第三周期VIA族,
故答案为:N;![]() ;三、VIA;
;三、VIA;
(2)科学家成功地在高压下将![]() 转化为具有空间立体网状结构的晶体,属于原子晶体,与二氧化硅晶体结构类似,该晶体中C原子形成4个键,没有孤对电子,碳原子杂化轨道类型是
转化为具有空间立体网状结构的晶体,属于原子晶体,与二氧化硅晶体结构类似,该晶体中C原子形成4个键,没有孤对电子,碳原子杂化轨道类型是![]() ,
,
故答案为:![]() ;
;
(3)![]() 、
、![]() 、
、![]() 三种离子组成的化合物
三种离子组成的化合物![]() ,其中化学键的类型有离子键、配位键、共价键,该化合物中存在一个复杂离子,该离子的化学式为:
,其中化学键的类型有离子键、配位键、共价键,该化合物中存在一个复杂离子,该离子的化学式为:![]() ,
,
故答案为:离子键、配位键、共价键;![]() ;
;
(4)“酒精检测仪”中有红色 故答案为:![]() 和少量
和少量![]() ,检测酒驾时反应的化学方程式为:
,检测酒驾时反应的化学方程式为:![]() ,
, ![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
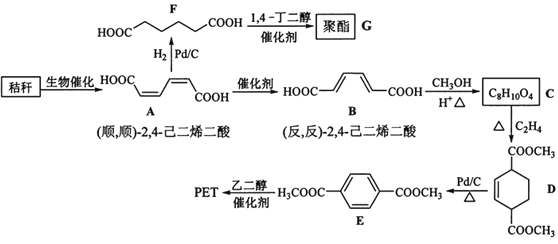
回答下列问题:
(1)下列关于糖类的说法正确的是___。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为___。
(3)D中官能团名称为____,D生成E的反应类型为___。
(4)F的化学名称是___,由F生成G的化学方程式为___。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成44gCO2,W共有___种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为____。
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B. 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br+2Cl2=2Fe3++Br2+4Cl
C. 向明矾溶液中滴加Ba(OH)2,恰好使![]() 沉淀完全:2Al3++3
沉淀完全:2Al3++3![]() +3Ba2++6OH=2A1(OH)3↓+3BaSO4↓
+3Ba2++6OH=2A1(OH)3↓+3BaSO4↓
D. 向碳酸钠溶液中滴加过量的稀硫酸:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
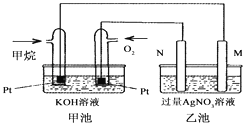
(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)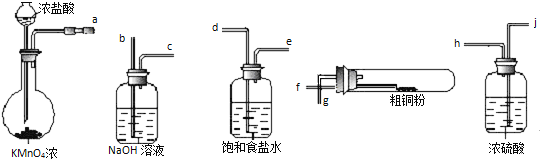
①按气流方向连接各仪器接口顺序是:![]() ______ .
______ .
②反应时,盛粗铜粉的试管中的现象是 ______ .
③已知:氯化铜溶液中有如下转化关系:
![]()
![]()
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 ______ ![]() 填序号
填序号![]() .
.
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入![]() 晶体,溶液变为绿色
晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列过程与氧化还原反应无关的是( )
A.酸性重铬酸钾用于检测酒精
B.铝粉与强碱溶液反应放热
C.植物油在空气中变质,产生“哈喇”味
D.海水经风吹日晒获得粗盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
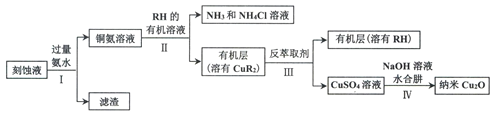
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com