
某研究性学习小组的同学通过课外学习了解到:某品牌牙膏中含有摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂等成分,其中的摩擦剂除了含CaCO3外,可能还含有Al(OH)3、SiO2中的一种或两种。为探究该品牌牙膏中摩擦剂的成分,该小组的同学进行了如下实验(牙膏中其他成分遇到盐酸时无气体产生):
请回答下列问题:
(1)操作Ⅰ中涉及的玻璃仪器有烧杯、________、________。
(2)写出下列操作过程涉及的离子方程式:
操作Ⅲ:______________________________,
操作Ⅳ:______________________________。
(3)该摩擦剂中除CaCO3外,肯定含有__________________。
(4)为进一步探究摩擦剂中碳酸钙的含量,该小组同学利用如图所示装置(图中夹持仪器略去)进行实验。
请回答下列问题:
①实验过程中需持续缓缓通入空气。其作用除了可充分混合装置乙和丙中的反应物外,还有________的作用;
②丙中主要反应的化学方程式是________________;
③实验中准确称取4.00 g样品三份,进行三次测定,测得BaCO3的平均质量为1.97 g,计算样品中碳酸钙的质量分数(要求有计算过程):__________________________;
④有同学认为只要测定装置丙在吸收CO2前后的质量差,不必测定装置丙中生成的BaCO3质量,一样可以确定碳酸钙的质量分数。你认为该方案是否可行?________,简述理由:________。
(1)玻璃棒 漏斗
(2)Al3++4OH-=AlO2-+2H2O SiO2+2OH-=SiO32-+H2O
(3)Al(OH)3、SiO2
(4)①把生成的CO2全部排入丙装置中,使之完全被Ba(OH)2吸收
②Ba(OH)2+CO2=BaCO3↓+H2O
③25% 由转化关系可知n(CaCO3)=n(CO2)=n(BaCO3)=1.97 g/197 g·mol-1=0.01 mol,所以m(CaCO3)=0.01 mol×100 g/mol=1.00 g,w(CaCO3)=1.00 g÷4.00 g×100%=25%
④不可行 乙中的水蒸气、HCl气体等进入装置丙中造成实验误差
解析


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL,甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举:
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
2-苯基-2-丁醇是重要的有机合成中间体,以溴苯为原料合成该中间体的反应原理如下:
【实验装置】

装置Ⅰ 装置Ⅱ
【实验步骤】
步骤1:将镁条置于装置Ⅰ的三颈烧瓶中,加入100 mL乙醚(ρ=0.71g·cm-3),在冷却条件下缓缓滴入溴苯,微热并加入一小块碘引发反应①。
步骤2:滴加14.2 mL丁酮和30 mL乙醚混合物,发生反应②;滴加入20%的NH4Cl水溶液,发生反应③。
步骤3:分出油层,用水洗涤至中性,用无水CaCl2干燥。
步骤4:用装置Ⅱ先蒸出乙醚,再蒸馏出产品。
⑴步骤1中加入碘的作用是 。
⑵装置Ⅰ中滴加液体所用的仪器的名称是 ,反应②需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,其目的是 。
⑶步骤三中分离出油层的具体实验操作是 。
⑷装置Ⅱ采用的是减压蒸馏,实验时需将吸滤瓶需连接 ;采用这种蒸馏方式的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数列于下表。
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75—85℃ | 500g·L—1 |
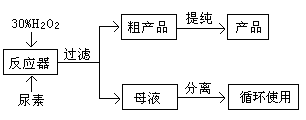

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。
| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。实际工业生产中,可用硫磺、浓硫酸代替原料中的SO2,其原因为 (用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的: 。
(3)吸收器中生成NaClO2的离子反应方程式为 ,其中反应温度不能高于5℃的可能原因: 。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
①为除去过量的SO2,C中盛放的试剂为 。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为 、Na2O2+SO2= Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室合成环己酮的反应、装置示意图及有关数据如下: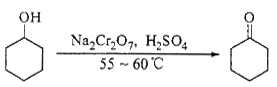

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: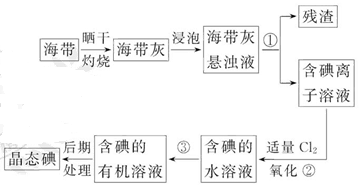
(1)步骤①的实验操作名称是_________;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是_________;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是_________;
| A.CCl4与水不互溶 |
| B.CCl4可与I2发生取代反应 |
| C.CCl4的密度比水大 |
| D.CCl4不易燃烧,可作灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
制备水杨酸对正辛基苯基酯(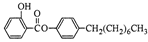 )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图12所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯,该反应为: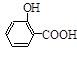 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→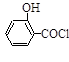 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚[ ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三中发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com