
【题目】金刚烷胺是一种抗病毒药物, 可阻止病毒穿入宿主细胞并有明显地抑制病毒脱壳的作用,可用于流感病毒A型感染性疾病的治疗,其合成线路图如图所示。[尿素的分子式为CO(NH2)2]下列说法错误的是( )
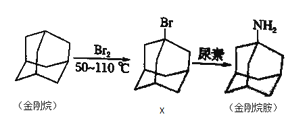
A.金刚烷的分子式是C10H16其不能使溴水和酸性KMnO4溶液褪色
B.中间产物X可发生消去反应,生成的有机产物只有一种
C.金刚烷胺碳原子上的一溴代物有两种
D.上述反应都属于取代反应
【答案】C
【解析】
A. 由金刚烷的结构简式可得,分子式是C10H16。分子内均为碳碳单键,故不能与溴水发生加成反应而褪色,也不能与酸性高锰酸钾发生氧化反应而褪色,A说法正确;
B. 中间产物X官能团为溴原子,与溴原子相连的碳原子同时连接3个-CH2-,则可以在氢氧化钠的乙醇溶液中加热,脱掉一分子溴化氢形成碳碳双键,发生消去反应;因为3个-CH2-具有相同的化学环境,只能生成一种产物,B说法正确;
C. 金刚烷胺除氨基上的氢原子,有三种等效氢,则金刚烷胺碳原子上的一溴代物有三种,而不是两种,C说法错误;
D. 金刚烷与Br2在50~110℃条件下生成X和HBr,金刚烷中氢原子被溴原子代替,属于取代反应。X与尿素反应,X中的溴原子被尿素中的氨基取代,发生取代反应,D项说法正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】囧烷(E)的一种合成路线如图:
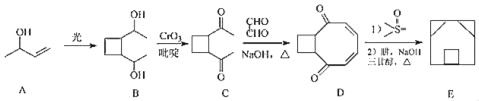
(1)A→B的反应类型为_____;
(2)E的分子式_____;A可用于合成一种重要的合成橡胶的单体,写出由A制备该单体的化学方程式为_____。
(3)满足下列条件的D的所有同分异体的结构简式为_____。
Ⅰ.含有1个苯环,无其它环状结构,能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有4组峰且面积比为3:3:2:2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
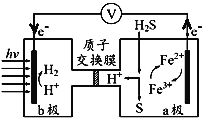
A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学采用萃取—分液的方法从碘水中提取碘,主要操作步骤如下图:

①该同学所采用的萃取剂可能是______________(填序号)。
A 酒精 B 苯 C 四氯化碳 D 汽油
②甲、乙、丙3步实验操作中,不正确的是_______________(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:A 饱和食盐水 B NaOH溶液
请在以上实际中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH =﹣566 kJ/mol
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2B.1∶3C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
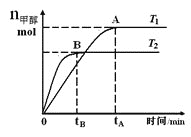
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为从光盘中提取Ag(其它金属微量忽略不计)对废旧资源进行回收利用的工艺流程,下列说法错误的是( )
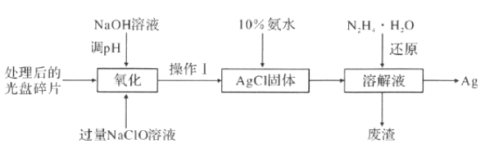
A.“氧化"阶段需在80 ℃条件下进行,则适宜的加热方式为水浴加热
B.“氧化“过程还生成O2,则反应方程式为4Ag+4NaClO+2H2O=4AgCl+ 4NaOH+O2↑
C.10%的氨水洛解AgCl团体,AgCl与NH3·H2O按1:2反应可生成Cl-和[Ag(NH3)2]+
D.“还原”过程中N2H4·H2O在碱性条件下转化为无害气体N2,则理论上生成22.4LN2可提取到43.2g的单质Ag。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2中的一或二种杂质.将13.8 g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0 g沉淀,则原样品中含有的杂质会是
A.肯定没有Na2CO3,Ba(NO3)2
B.肯定有Na2CO3,没有Ba(NO3)2
C.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
D.无法判断何种为肯定或否定的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是在中国化学工业史上一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,以下是侯德榜先生制碱工业的简要流程:
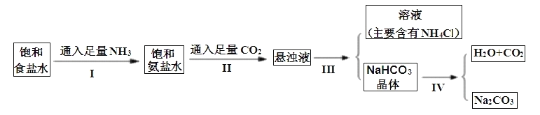
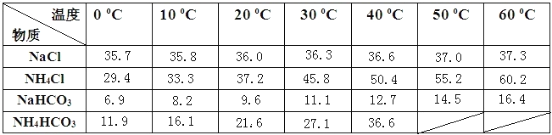
下表是四种物质在100g水中不同温度的溶解度,其中NH4HCO3水溶液呈碱性,性质不稳定,36℃时开始分解为二氧化碳、氨和水,60℃可以分解完。
试回答下列问题:
(1)IV的反应条件是加热,请尝试写出IV的反应方程式:________________________。
(2)Ⅲ的操作名称叫____________。
(3)通过上述溶解度表,如何从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com