
下列说法不正确的是( )
A.焓是与内能有关的物理量,当反应在恒压条件下进行时,反应热效应等于焓
B.当能量变化以热的形式表现时,将反应分为放热反应和吸热反应
C.测定中和反应的反应热时,为提高实验准确性,使用稍过量的碱
D.新能源有太阳能、氢能、风能、生物质能等,它们都是可再生的
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取
FeCl3·6H2O晶体。(图中夹持及尾气处理装置均己略去)

(1)装置B中发生反应的化学方程式是___________________________。
(2)装置B中的现象是________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________。 在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是________________________。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
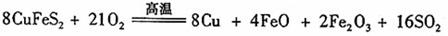
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锂电池的构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC6 LiCoO2+6C,下列说法错误的是( )
LiCoO2+6C,下列说法错误的是( )
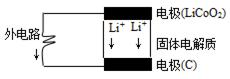
A.该电池的负极为LiCoO2
B.电池中的固体电解质可以是熔融的氯化钠、干冰等
C.充电时的阴极反应:Li1-xCoO2+xLi++xe-=LiCoO2
D.外电路上的“→”表示放电时的电子流向
查看答案和解析>>
科目:高中化学 来源: 题型:
应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________ 。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g)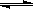 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是Ⅰ Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是Ⅰ Ⅱ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
完全燃烧一定量的乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则相同条件下燃烧1mol乙醇放出的热量是( )
A. 0.2Q B. 0.1Q
C. 5Q D. 10Q
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高

查看答案和解析>>
科目:高中化学 来源: 题型:
有关杂化轨道的说法不正确的是
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释
D.杂化轨道全部参加形成化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
小明和小红对市场上销售的一种分袋包装的蛋糕发生了兴趣,因为蛋糕包装在充满气
体的小塑料袋内,袋内的气体充得鼓鼓的,看上去好像一个小“枕头”。他们认为这
种充气包装技术,主要是为了使食品能够较长时间地保鲜、保质。那么,这是什么气
体呢?小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,判断小明的猜想是否正确,简要写出操
作步骤: _________________________________________________________ _____。
(2)小明的猜想如果正确,现象应是________________________ _________。
(3)你认为食品充气包装对所充气体的要求是: ①_________ _____________;
②________________ ________;③_____ ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com