
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_____________________________。
(3)起始时向某恒容绝热容器中充入1mol CH2=CHCH3和1mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
【答案】164 增大 反应I是一个气体物质的量减小的反应,达到平衡后增大压强,反应I正向移动,CH2ClCHClCH3的产率增大 增大 0.09 74% 0.21
【解析】
(1)已知:I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
根据盖斯定律I–II得到CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g) H=H1
CH2ClCHClCH3(g) H=H1![]() H2=-32kJ·mol1,且H=Ea(正)
H2=-32kJ·mol1,且H=Ea(正)![]() Ea(逆),则Ea(逆)=164kJ·mol1;
Ea(逆),则Ea(逆)=164kJ·mol1;
(2)恒温恒压密闭装置中,根据平衡移动原理,增大压强平衡向气体粒子数目减小的方向进行,该反应往正向移动,故CH2ClCHClCH3的产率增大;
(3)根据气体状态方程PV=nRT,V、n是定值,R是常数,压强随T增大而增大,由于容器是绝热恒容,与外界没有热量交换,对于反应II正反应放热,体系吸收热量,绝热容器的温度升高,故体系压强增大;
(4)①恒温恒容的密闭装置,初始通入等物质的反应物初始体系总压80 kPa,,120min总压为69.4 kPa,减小量为10.6 kPa,根据反应I方程分析CH2ClCHClCH3分压10.6 kPa,根据![]() ,v(CH2ClCHClCH3)=
,v(CH2ClCHClCH3)=![]() kPa·min1;
kPa·min1;
②设初始充入等物质的量的CH2=CHCH3和Cl2均为1mol,平衡时刻CH2ClCHClCH3为xmol,生成CH2=CHCH2Cl和HCl均为ymol,由于压强之比等于气体物质的量之比,有![]() ,得x=0.56mol,又有平衡时HCl的体积分数为
,得x=0.56mol,又有平衡时HCl的体积分数为![]() ,有
,有![]() =
=![]() ,得y=0.18mol,因此平衡时刻CH2=CHCH3和Cl2均为0.26mol,CH2ClCHClCH3为0.56mol,CH2=CHCH2Cl和HCl均为0.18mol,混合气体的总物质的量为1.44mol,故丙烯的平衡总转化率
,得y=0.18mol,因此平衡时刻CH2=CHCH3和Cl2均为0.26mol,CH2ClCHClCH3为0.56mol,CH2=CHCH2Cl和HCl均为0.18mol,混合气体的总物质的量为1.44mol,故丙烯的平衡总转化率![]()
![]() 100%=74%;反应I中CH2=CHCH3和Cl2物质的量分数均为
100%=74%;反应I中CH2=CHCH3和Cl2物质的量分数均为![]() ,且分压均为57.6×
,且分压均为57.6×![]() kPa,CH2ClCHClCH3物质的量分数
kPa,CH2ClCHClCH3物质的量分数![]() ,且分压为57.6×
,且分压为57.6×![]() kPa,则Kp=
kPa,则Kp=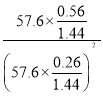
![]() 0.21 kPa1。
0.21 kPa1。


科目:高中化学 来源: 题型:
【题目】如图所示装置,两个相同的玻璃管中盛满NaCl稀溶液(滴有酚酞),a、b为多孔石墨电极。闭合S1一段时间后,a附近溶液逐渐变红;断开S1,闭合S2,电流表指针发生偏转。
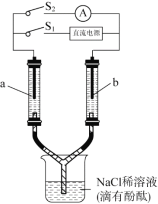
下列分析不正确的是
A.闭合S1时,a附近的红色逐渐向下扩散
B.闭合S1时, a附近液面比b附近的低
C.断开S1、闭合S2时,b附近黄绿色变浅
D.断开S1、闭合S2时,a上发生反应:H2 2e- = 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸(H3AsO4)是三元弱酸,剧毒,可用于制备颜料、砷酸盐、杀虫剂等。常温下,其溶液中含砷的各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。在常温下,下列说法错误的是
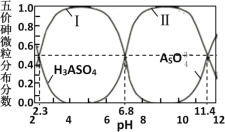
A.曲线Ⅱ代表HAsO![]() 的分布分数
的分布分数
B.该砷酸溶液:Ka2/Ka3=104.6
C.等物质的量浓度的H3AsO4溶液和NaOH溶液等体积混合后所得溶液:pH>7
D.0.1mol/L的Na2HAsO4溶液中: c(HAsO![]() )> c(H2AsO
)> c(H2AsO![]() )> c(AsO
)> c(AsO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 X(s)+3Y(g) ![]() Z(g)+2W(g) △H>0,在恒容绝热容器中加入 1 mol X 和 3 mol Y 发生反应,下列说法正确的是
Z(g)+2W(g) △H>0,在恒容绝热容器中加入 1 mol X 和 3 mol Y 发生反应,下列说法正确的是
A.在反应的过程中,加入更多的 X,化学反应速率加快
B.在反应的过程中,容器内的压强保持不变
C.相同时间内,消耗 0.1 mol X 的同时,生成 0.2 mol W,说明反应到达平衡状态
D.随着反应的进行,容器内气体的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两种金属单质组成的混合物11g,加到足量稀硫酸中,最终得到11.2L(标准状况下)的氢气,这两种金属可能是( )
A.Zn和FeB.Ag和MgC.Al和 CuD.Mg和Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
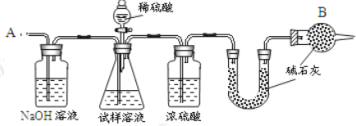
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I等)中回收碘,其实验过程如下:
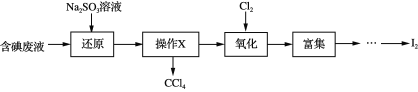
下列叙述不正确的是
A.“还原”步骤发生的反应为:SO32+I2+H2O == 2I+SO42+2H+
B.“操作X”为静置、分液,所得CCl4可用作“富集”的萃取剂
C.“氧化”过程中,为使I完全被氧化,需长时间通入Cl2
D.“富集”即I2富集于有机溶剂,同时除去某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯与苯乙烯具有相同最简式但不是同系物
B.乙醚和乙醇互为同分异构体
C.CH3—C≡C—CH=CH—![]() —CH3分子中最多可以有20个原子共平面
—CH3分子中最多可以有20个原子共平面
D.CH3CH2CH2CH3 和C(CH3)4互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
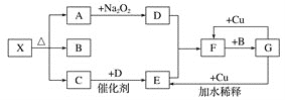
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com