
【题目】将两种金属单质组成的混合物11g,加到足量稀硫酸中,最终得到11.2L(标准状况下)的氢气,这两种金属可能是( )
A.Zn和FeB.Ag和MgC.Al和 CuD.Mg和Zn
【答案】C
【解析】
标准状况下11.2L氢气的物质的量为![]() =0.5mol,
=0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的摩尔质量=![]() =22g/mol,则其相对原子质量的数值为22,据此分析作答。
=22g/mol,则其相对原子质量的数值为22,据此分析作答。
A.Zn、Fe在反应中都表现+2价,Zn的相对原子质量为65,Fe的相对原子质量为56,二者平均相对原子质量介于56~65之间,大于金属混合物的平均相对原子质量为22,故A错误;
B.Ag不反应,其的相对原子质量看做无穷大,Mg在反应中表现+2价,相对原子质量为24,二者平均相对原子质量大于24,故B错误;
C.当Al的化合价为+2价时,可看成其相对原子质量为![]() ×27=18,Cu不反应,其的相对原子质量看做无穷大,平均值可能为22,故C正确;
×27=18,Cu不反应,其的相对原子质量看做无穷大,平均值可能为22,故C正确;
D.Mg、Zn在反应中都表现+2价,Mg的相对原子质量为24,Zn的相对原子质量为65,二者平均相对原子质量介于24~65之间,大于金属混合物的平均相对原子质量为22,故D错误,;
故选:C。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】25oC时,浓度均为0.1 mol·L–1的几种溶液的pH如下:
溶液 | ①CH3COONa溶液 | ②NaHCO3溶液 | ③CH3COONH4溶液 |
pH | 8.88 | 8.33 | 7.00 |
下列说法不正确的是
A.①中, c(Na+) = c(CH3COO–) + c( CH3COOH)
B.由①②可知,CH3COO–的水解程度大于![]() 的水解程度
的水解程度
C.③中,c(CH3COO–) = c(NH4+) < 0.1 mol·L–1
D.推测25oC,0.1 mol·L–1 NH4HCO3溶液的pH <8.33
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A.常温常压下,71g Cl2含有的氯原子数为2NA
B.1mol Na2O2与H2O完全反应,转移电子数为NA
C.在标准状况下,1L H2O所含分子数为![]()
D.1L 0.5mol/L AlCl3溶液中,含有的Cl–数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
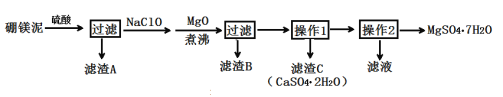
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g) ![]() CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
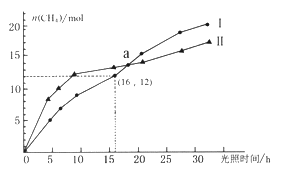
A. 0-15h内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
B. 反应开始后的30h内,第Ⅰ种催化剂的作用下,反应吸收的热量多
C. a点时,CO2的转化率相等
D. 0-16h内,v(O2)=1.5mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_____________________________。
(3)起始时向某恒容绝热容器中充入1mol CH2=CHCH3和1mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)基态钴原子的价电子排布式为____,Mn位于元素周期表的____ 区(填“s”或“p”或“d”或“ds”或“f”)。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___。PO43-的空间构型是 ___,中心原子的杂化方式是 ____。
(3)CoO、MnO两种氧化物的熔点由高到低的顺序是 ___,原因是 ___。
(4)PH3是____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是 _____
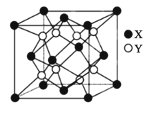
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag.cm-3,则距离最近的两个S2-的距离是___nm。(用含a、M、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目_______。
(2)若生成0.2mol的NO,则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2,写出该化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com