
【题目】托特罗定(G)是毒蕈碱受体拮抗剂,其一种合成路线流程图如下:
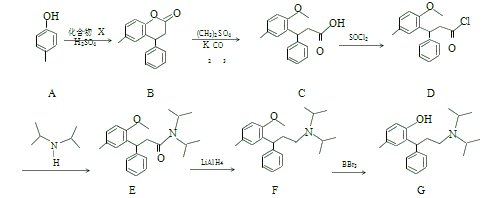
请按要求回答下列问题:
(1)A 的名称:_____;最多共平面的原子数目为_____。C 中含氧官能团名称为_________。
(2)D→E的反应类型为_____。
(3)B 与 NaOH 溶液加热条件下反应的化学方程式:____________。
(4)C→D 反应过程使用的液态 SOCl2(![]() )沸点为 77℃,遇水剧烈反应,产生酸雾和刺激性气味的气体。写出 SOCl2 与水的化学方程式:____________。
)沸点为 77℃,遇水剧烈反应,产生酸雾和刺激性气味的气体。写出 SOCl2 与水的化学方程式:____________。
(5)同时满足下列条件的 C 的同分异构体共有______________种。写出其中一种结构简式______________。
a.在酸性条件下完全水解,得到两种产物:有机物 M 和碳酸(![]() )
)
b.M 分子中有 4 种不同化学环境的氢,且能与 FeCl3 溶液发生显色反应。
(6)已知:R'-CHO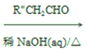 R'-CH=CCHO (R1、R2 代表烃基或 H),请结合上述信息,写出以
R'-CH=CCHO (R1、R2 代表烃基或 H),请结合上述信息,写出以![]() 和乙醛为主要原料制备
和乙醛为主要原料制备 ![]() 的合成路线流程图_____________(无机试剂任选):
的合成路线流程图_____________(无机试剂任选):
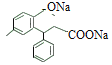
【答案】4-甲基苯酚或对甲基苯酚 14 醚键、羧基 取代反应 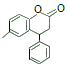 +2 NaOH
+2 NaOH![]()
 +H2O SOCl2+H2O=SO2+2HCl 2
+H2O SOCl2+H2O=SO2+2HCl 2 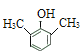 、
、
【解析】
(1)有机物命名,A(![]() )以苯酚为母体,苯环上的甲基与羟基对位关系,名称为4-甲基苯酚或对甲基苯酚;共面问题,苯环上的原子在同一个平面上,另外甲基上的C原子采用的sp3杂化,单键可以旋转,故甲基上的有一个氢原子可能在苯环所构成的这个平面上;
)以苯酚为母体,苯环上的甲基与羟基对位关系,名称为4-甲基苯酚或对甲基苯酚;共面问题,苯环上的原子在同一个平面上,另外甲基上的C原子采用的sp3杂化,单键可以旋转,故甲基上的有一个氢原子可能在苯环所构成的这个平面上;
(2)从反应物和生成物的结构简式上可以看出D中的Cl原子被![]() 所取代,故D→E的反应类型为取代反应;
所取代,故D→E的反应类型为取代反应;
(3)酯的水解反应,注意这个酯与其他的酯的不同之处,它水解生成的酚羟基也可以与氢氧化钠反应,故1molB 与 NaOH 溶液加热条件下反应,消耗2mol NaOH,反应方程式为 +2 NaOH
+2 NaOH![]()
 +H2O;
+H2O;
(4)结合题中的已知信息,推测生成物为SO2、HCl,然后写出相应的化学反应方程式;
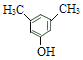
(5)满足下列条件的 C 的同分异构体a.在酸性条件下完全水解,得到两种产物:有机物 M 和碳酸(![]() );b.M 分子中有 4 种不同化学环境的氢,且能与 FeCl3 溶液发生显色反应,M分子中含有酚羟基,满足条件的M的结构简式有:
);b.M 分子中有 4 种不同化学环境的氢,且能与 FeCl3 溶液发生显色反应,M分子中含有酚羟基,满足条件的M的结构简式有: 、
、 ,符合条件的C的同分异构体共2种;
,符合条件的C的同分异构体共2种;
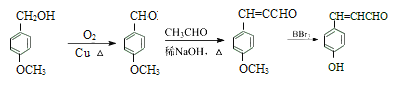
(6)结合已知提示信息和托特罗定一种合成路线流程图中的信息,进行新的流程图设计,![]() 与O2在Cu作催化剂的条件下催化氧化生成
与O2在Cu作催化剂的条件下催化氧化生成![]() ,结合题中所给已知信息,
,结合题中所给已知信息,![]() 与乙醛在稀的氢氧化钠溶液加热的条件下反应生成
与乙醛在稀的氢氧化钠溶液加热的条件下反应生成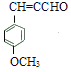 ,再结合流程图中的信息,
,再结合流程图中的信息, 在BBr3作用下生成
在BBr3作用下生成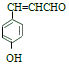 。
。
(1)A(![]() )以苯酚为母体,名称为4-
)以苯酚为母体,名称为4-
(2)D中的Cl原子被![]() 所取代,故D→E的反应类型为取代反应;
所取代,故D→E的反应类型为取代反应;
(3)B分子中含有酯基,在NaOH溶液中发生水解反应, +2 NaOH
+2 NaOH![]()
 +H2O;
+H2O;
(4)液态 SOCl2(![]() )沸点为 77℃,遇水剧烈反应,产生酸雾和刺激性气味的气体,该刺激性气味的气体为SO2,另一种物质是HCl,SOCl2 与水的化学方程式:SOCl2+H2O=SO2+2HCl;
)沸点为 77℃,遇水剧烈反应,产生酸雾和刺激性气味的气体,该刺激性气味的气体为SO2,另一种物质是HCl,SOCl2 与水的化学方程式:SOCl2+H2O=SO2+2HCl;
(5)同时满足下列条件的 C 的同分异构体a.在酸性条件下完全水解,得到两种产物:有机物 M 和碳酸(![]() );b.M 分子中有 4 种不同化学环境的氢,且能与 FeCl3 溶液发生显色反应,M分子中含有酚羟基,满足条件的M的结构简式有:
);b.M 分子中有 4 种不同化学环境的氢,且能与 FeCl3 溶液发生显色反应,M分子中含有酚羟基,满足条件的M的结构简式有: 、
、 ,符合条件的C的同分异构体共2种;
,符合条件的C的同分异构体共2种;
(6)![]() 与O2在Cu作催化剂的条件下催化氧化生成
与O2在Cu作催化剂的条件下催化氧化生成![]() ,结合题中所给已知信息,
,结合题中所给已知信息,![]() 与乙醛在稀的氢氧化钠溶液加热的条件下反应生成
与乙醛在稀的氢氧化钠溶液加热的条件下反应生成 ,再结合流程图中的信息,
,再结合流程图中的信息, 在BBr3作用下生成
在BBr3作用下生成 ,具体合成路线如下:
,具体合成路线如下: 。
。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如图(部分反应条件和产物略去)。

已知:Ⅰ.RCHO+R’CH2CHO +H2O
+H2O
Ⅱ.![]() (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子)
Ⅲ.A为饱和一元醇,其氧的质量分数约为34.8%,请回答:
(1)C中官能团的名称为_____,该分子中最多有_____个原子共平面。
(2)D与苯甲醛反应的化学方程式为_____。
(3)③的反应类型是____。
(4)PVAc的结构简式为____。
(5)写出与F具有相同官能团的同分异构体的结构简式____(任写一种)。
(6)参照上述信息,设计合成路线以溴乙烷为原料(其他无机试剂任选)合成 。____。
。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
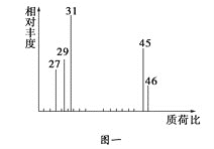
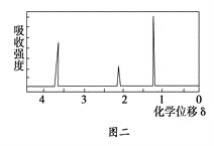
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
下表是常温下几种难(微)溶物的溶度积常数(Ksp):
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(l)写出HCN的电离方程式:___________,HClO的电子式__________。
(2)表中所给的四种酸中,酸性最强的是__________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大且电离常数改变的操作是__________(填字母序号)。
A.加少量冰酷酸 B.降低温度 C.加水稀释 D.升高温度 E.加少量的CH3COONa固体
(3)CH3COONH4的水溶液呈__________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是__________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BasO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.02 mol·L-1,则溶液中CO32-物质的量浓度应≥__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是 ( )
H++OH-,向右移动且溶液呈酸性的是 ( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE的路线如下:
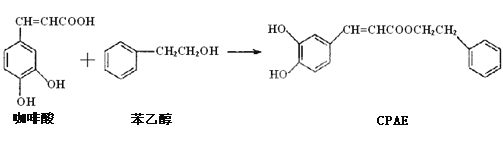 +H2O
+H2O
下列关于上述所列有机物的说法中正确的是( )
A.咖啡酸、CPAE及苯乙醇都能发生取代、加成、氧化及消去反应
B.用FeCl3溶液可以来检测上述反应中是否有CPAE生成
C.苯乙醇是最简单的芳香醇,与邻乙基苯酚互为同系物关系
D.1mol的咖啡酸最多可与4mol Br2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]·3H2O)易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:
Fe +H2SO4 = FeSO4 +H2↑
FeSO4 + H2C2O4 + 2H2O =FeC2O4·2H2O↓+ H2SO4
2FeC2O4·2H2O + H2O2 + H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
回答下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是________(选填序号);
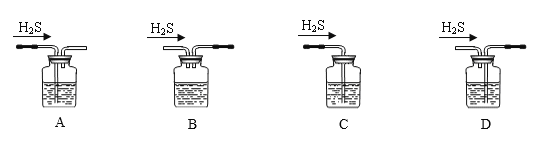
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40℃,理由是________;
(3)得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入_____溶剂(填编号)
a. 冰水 b. 无水乙醇 c. 四氯化碳
(4)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④步,⑥计算。
步骤⑤也被称做________操作,其目的是____________________________;
(5)重量分析法测定时,步骤③未在干燥器中进行,那么测得的晶体中所含结晶水含量________(填“偏高”、“偏低”或“无影响”);
(6)三草酸合铁(Ⅲ)酸钾晶体用重量分析法测定时,2.810g的晶体经操作最终获得了2.480g无水物,则此次测定的相对误差为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究 CO、CO2 的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g) ![]() CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
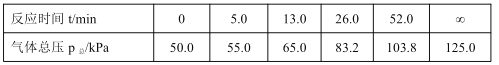
由表中数据计算:0~5.0 min 内的平均反应速率 v(CH3OCH3)=__________,该温度下平衡常数 K=_______________ 。
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4 混合气体发生如下反应:CO(g)+CH4(g) ![]() CH3CHO(g),反应速率 v正 v逆=k正p(CO)p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 v逆=k正p(CO)p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,![]() =____________。
=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com