
【题目】下列物质均为Wg,将它们在氧气中完全燃烧的产物全部通入到过量的过氧化钠固体中,则过氧化钠固体增重为大于Wg的是()
①CH3CH2OH②HOOCCOOH③CH4④HCHO⑤CH3COOH⑥HCOOH
A. ④⑤ B. ②⑥ C. ①③ D. ①②③
【答案】C
【解析】
H2、CO发生的化学方程式为:2H2+O2![]() 2H2O,2Na2O2+2H2O=4NaOH+O2↑;2CO+O2
2H2O,2Na2O2+2H2O=4NaOH+O2↑;2CO+O2![]() 2CO2 ,2Na2O2+2CO2=2Na2CO3+O2,由反应方程式可知,过氧化钠增加的质量即为H2、CO的质量。因此只要是CO或H2或它们的气体或化学组成符合通式:(CO)m·(H2)n,则过氧化钠固体增重质量等于原物质的质量;若分子中碳、氧原子个数比大于1:1,则过氧化钠固体增重的质量大于原物质的质量;若分子中碳、氧原子个数比小于1:1,则过氧化钠固体增重的质量小于原物质的质量;据此分析可得结论。
2CO2 ,2Na2O2+2CO2=2Na2CO3+O2,由反应方程式可知,过氧化钠增加的质量即为H2、CO的质量。因此只要是CO或H2或它们的气体或化学组成符合通式:(CO)m·(H2)n,则过氧化钠固体增重质量等于原物质的质量;若分子中碳、氧原子个数比大于1:1,则过氧化钠固体增重的质量大于原物质的质量;若分子中碳、氧原子个数比小于1:1,则过氧化钠固体增重的质量小于原物质的质量;据此分析可得结论。
①CH3CH2OH分子中碳、氧原子个数为2:1,大于1:1,故过氧化钠固体增重大于Wg;
②HOOCCOOH分子碳、氧原子个数比为1:2,小于1:1,故过氧化钠固体增重小于Wg;
③CH4分子中没有氧原子,故过氧化钠固体增重大于Wg;
④HCHO可以改写成CO·H2,符合通式:(CO)m·(H2)n,故过氧化钠固体增重等于Wg;
⑤CH3COOH可以改写成(CO)2·(H2)2,符合通式:(CO)m·(H2)n,故过氧化钠固体增重等于Wg;
⑥HCOOH分子中碳、氧原子个数比为:1:2,小于1:1,故过氧化钠固体增重小于Wg;
故答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下:
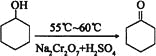
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm—3、20 ℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是 。
(2)b中水层用乙醚萃取的目的是 。
(3)以下关于萃取分液操作的叙述中,不正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图( )用力振荡
)用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是 。蒸馏除乙醚的操作中,采用的加热方式为 。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A. H2(g)+Br2(g)![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B. 2NO2(g)![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C. CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D. N2(g)+3H2(g)![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+ CaCl2+ 2H2SO4 ![]() 2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。
2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。

试回答:
(1)该实验中A部分的装置是________(填写装置的序号)。
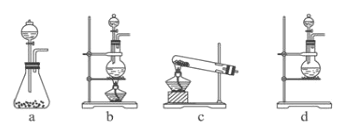
(2)B中的实验现象为___________________________ 。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因,_____________________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)_____________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如图:
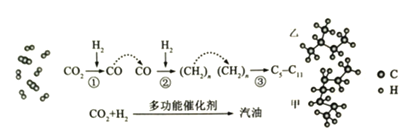
回答下列问题:
(1)二氧化碳分子中的化学键是______,物质乙的结构简式是______。
(2)写出反应![]() 的化学方程式______。
的化学方程式______。
(3)实验室常用纯净碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的体积V(CO2)与时间关系如图:
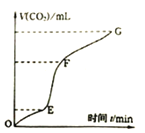
①由图象分析,化学反应速率最快一段是______。
②为了增大上述化学反应的反应速率,欲向溶液中加入下列物质或采取如下操作,你认为可行的是______![]() 填写序号
填写序号![]() 。
。
A.蒸馏水 B.氯化钠溶液 C.浓盐酸 D.加热
(4)二氧化碳能与氢氧化钠溶液反应,当二氧化碳与氢氧化钠反应的物质的量之比为2∶3时,溶液中的溶质是________。(填化学式)
(5)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为:CO2+3H2![]() CH3OH+H2O。将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0-tmin内CO2的反应速率为______mol/(L·s)。[X的反应速率ν(X)=
CH3OH+H2O。将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0-tmin内CO2的反应速率为______mol/(L·s)。[X的反应速率ν(X)=![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O)可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15是化工生产中以辉钼矿(主要成分为硫化钼MoS2)为原料来制备金属钼、钼酸钠晶体的主要流程图。
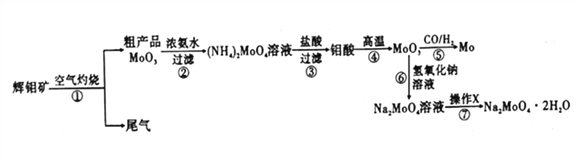
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X中应控制温度的最佳范围为_______(填序号)。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7)可用还原性气体(CO和H2)还原MoO3制钼,业上制备还原性气体CO和H2的反应原理之一为CO2+CH4![]() 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1 mol B的气体与足量的氢气完全反应共有0.4 mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请回答下列问题:
(1)写出A元素的最高价氧化物的电子式_____________。
(2)B元素在周期表中的位置为_____________。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有______________。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2∶1的化合物,用电子式表示该化合物的形成过程______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com