
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程。
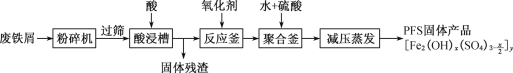
回答下列问题
(1)粉碎过筛的目的是___。
(2)酸浸时最合适的酸是___。
(3)若反应釜中加入氧化剂是H2O2,写出该反应的离子方程式___。
【答案】选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率 硫酸 2Fe2++2H++H2O2=2Fe3++2H2O
【解析】
废铁屑粉粹过筛后酸浸,过滤得到滤液在反应釜中加入氧化剂氧化亚铁离子为铁离子,加入水和硫酸生成聚合硫酸铁,减压蒸发得到PFS固体产品。
(1)铁锈的主要成分是氧化铁水合物,粉碎过筛是选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率;
(2)依据制备的物质聚合硫酸铁可知,酸化反应不能引入新的杂质,酸浸时最合适的酸是硫酸;
(3)反应釜中加入氧化剂H2O2把亚铁离子氧化为铁离子,铁的化合价由+2升高为+3,氧元素化合价由-1降低为-2,根据得失电子守恒,配平反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列6种有机物: ①CH3CH2CH2CH3②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() 请回答:
请回答:
(1)属于醇类的是_________(填序号).
(2)与①互为同分异构体的是________(填序号).
(3)与④互为同系物的是_________(填序号).
(4)用系统命名法给③命名,其名称为__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是

A. 水很稳定(1000℃以上才会部分分解),但与水中含有大量氢键无关
B. [Cu(NH3)4]SO4和(NH4)2SO4两种物质中都有配位键,所以都是配合物
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D. 由如图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质。

(1)写出仪器B的名称:B:___。
(2)当打开K1、关闭K2时,利用Ⅰ、Ⅱ装置可直接进行的实验是___(填序号)。
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
小颖认为在不改变Ⅰ、Ⅱ装置的仪器及位置的前提下,该装置可用于双氧水制取氧气,该反应的化学方程式是___,她的做法是___;实验室还可以用高锰酸钾制取氧气,化学方程式为___。
(3)当打开K2、关闭K1时,利用Ⅰ、Ⅲ装置可验证二氧化碳与水反应,生成了碳酸,此时试管中盛放的物质是___,可以观察到的现象是___(C为干燥管,用于防止液体倒吸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
汽车彻底改变了我们生活,成为我们的不可或缺的交通工具之一。汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放,在催化转化器的前半部发生的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
【1】上述催化器中发生的反应属于
A.复分解反应B.分解反应C.置换反应D.不属于四种基本反应
【2】关于反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)中,下列说法正确的是
2CO2(g)+N2(g)中,下列说法正确的是
A.CO作氧化剂B.CO发生氧化反应
C.NO被氧化D.NO作还原剂
【3】已知汽车尾气处理反应能量过程如下图,下列说法正确的是

A.该反应为放热反应
B.该反应为吸热反应
C.形成N≡N化学键需要吸收热量
D.反应物的总能量小于生成物的总能量
【4】下列反应条件的改变对该反应速率的影响正确的是
A.升高温度能减慢反应速率
B.增大反应物浓度能减缓反应速率
C.达到平衡时,CO能100%转化为CO2
D.使用催化剂能加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
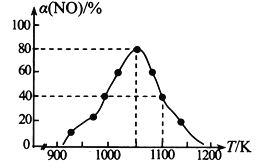
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
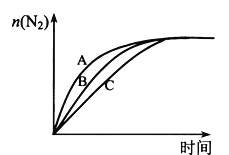
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
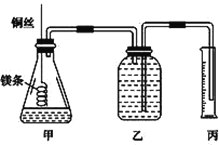
主要操作步骤如下:
①配制一定体积1.0 mol/L的盐酸溶液;
②量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题。
(1)为使HCl全部参加反应,a的数值至少为___________;若实验中至少需要220mL上述盐酸,配制该盐酸溶液需量取36.5% 1.18g/cm3的浓盐酸______mL。
(2)在配制溶液中,以下操作会使溶液浓度偏低的是_______(填序号)
A、在溶解过程中有少量液体溅出烧杯外 B、定容时仰视刻度线
C、量取浓盐酸时仰视刻度线 D、容量瓶洗净后没有干燥直接配制
(3)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(4)若忽略水蒸气的影响,读数时除恢复到室温外,还要注意_____________________。在实验条件下测得气体摩尔体积的计算式为Vm=________(用含V的表达式表示),若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com