
【题目】H2O2可降解废水中的有机物,活性炭(AC)能促进H2O2分解产生羟基自由基(·OH),提高对水中有机化合物的降解率。实验表明,AC表面的酸碱性会影响H2O2的分解反应。实验室中,将纯化的AC在氮气(60mL·min-1)和氨气(20mL·min-1)气氛中于650℃热处理2h可制得氨气改性活性炭(ACN)。回答下列问题:
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6h除去灰分,用蒸馏水洗涤至中性。研磨的目的是_____________。为了防止放置过程中再次吸水,烘干后的AC应置于_________(填仪器名称)中备用。
(2)制备ACN:
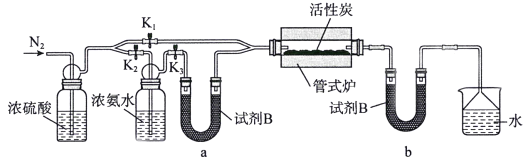
检查装置气密性并加入药品后,加热前应进行的操作是_________,其目的是_________;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为______________。U型管b内试剂B的作用是____________________。
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入ACN 0.5g,加入0.05mol· L-1的X溶液a mL。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1mol·L-1的标准盐酸反滴定剩余的X溶液,标准盐酸的平均用量为bmL。则X为________(填“NaOH”“Na2CO3”或“NaHCO3”),计算所得活性炭表面的羧基含量为______mol·kg-1(已知:ACN中,羧基的Ka=1.0×10-4、酚羟基的Ka=5.0×10-9、碳酸的Ka1=4.2×10-7、Ka2=5.6×10-11;用含a、b的代数式表示)。
(4)某课题组以2500mg·L-1苯酚溶液为模型废水,研究AC和ACN表面的酸碱性对H2O2降解苯酚的影响,得到如下图像:
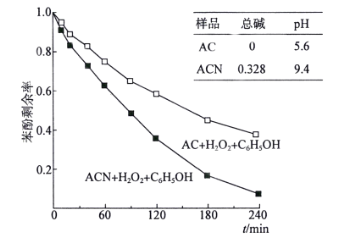
由图像可知,________(填“AC”或“ACN”)更有利于H2O2降解苯酚,原因是__________________________________。
【答案】增大接触面积,提高酸洗涤效率 干燥器 通入氮气 将装置内的空气赶走,以免干扰实验 关闭K1,打开K2、K3 防止烧杯中的水蒸气进入管式炉 NaHCO3 0.1a-0.2b ACN ACN表面呈碱性,有利于双氧水分解产生羟基
【解析】
(1)研磨的目的是增大接触面积,提高酸洗涤效率;为了防止放置过程中再次吸水,烘干后的AC应置于干燥器中备用,故答案为:增大接触面积,提高酸洗涤效率;干燥器;
(2)加热前应通入氮气,将装置内的空气赶走,以免干扰实验;关闭K1,打开K2、K3,打开电炉并加热反应管; U型管b内试剂B的作用是防止烧杯中的水蒸气进入管式炉,故答案为:通入氮气;将装置内的空气赶走,以免干扰实验;关闭K1,打开K2、K3;防止烧杯中的水蒸气进入管式炉;
(3)能和酚羟基反应的有:Na2CO3,NaOH;能和羧酸反应的有:Na2CO3,NaOH,NaHCO3,所以测定羧基含量用NaHCO3标准溶液;根据NaHCO3+HCl=NaCl+CO2↑+H2O可知,剩余的n(NaHCO3)= n(HCl)=0.1×b×10-3 mol,根据CH3COOH+ NaHCO3=CO2↑+H2O+ CH3COONa,n(CH3COOH)=(0.05×a×0-3-0.1×b×10-3)mol,羧基含量为[(0.05×a×0-3-0.1×b×10-3)/0.5×10-3]mol·kg-1=(0.1a-0.2b) mol·kg-1,故答案为:NaHCO3;0.1a-0.2b;
(4)根据图像可知,ACN苯酚剩余率更少,降解的更多,因为ACN与AC的pH相比,ACN表面显碱性,有利于双氧水分解产生羟基,故答案为:ACN;ACN表面呈碱性,有利于双氧水分解产生羟基。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
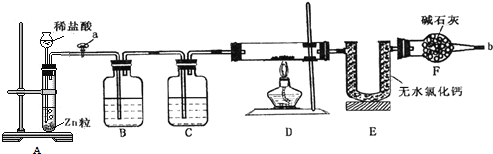
(1)实验前如何检验装置A的气密性________________________________________;
(2)为了实验安全,在点燃酒精灯前,在F装置出口b处必须_____________________;
(3)装置C中盛装的液体是浓硫酸,则装置B的作用是_________________________;
(4)U形管E右边又连接干燥管F的目的是___________。
(5)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U形管的质量增加7.2 g,则混合物中Fe2O3的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
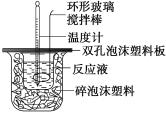
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对高温条件下反应机理的研究一直是化学动力学的重要课题,科研工作者研究了1000K下丙酮的热分解反应并提出了如下反应历程:
![]() ①
①![]()
![]() ②
②![]()
![]() ③
③![]()
![]() ④
④![]()
![]() ⑤
⑤![]()
回答下列问题:
(1)上述历程是根据两个平行反应提出的,其中一个为CH3COCH3![]() CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
(2)CH2=C=O(乙烯酮)可以与乙醇发生加成反应生成酯,写出该反应的化学方程式:____________________________________。
(3)一定温度下,在2L密闭容器中充入1molCH3COCH3发生上述两个平行反应,提高乙烯酮反应选择性的关键因素是___________;
a.再充入1molCH3COCH3 b.及时分离出CH4 c.使用适宜的催化剂
达到平衡后,测得容器中存在a molCH4和b mol CO,则CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
(4)分解产物中的CH4可用于制备氢气:
反应I:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=206.2kJ·mol-1
CO(g)+3H2(g) △H=206.2kJ·mol-1
反应Ⅱ:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=165.0kJ·mo1-1
CO2(g)+4H2(g) △H=165.0kJ·mo1-1
写出CO与水蒸气反应生成CO2的热化学方程式:_________________。830℃时,反应Ⅱ的平衡常数K=1.2mol2·L-2,该温度下,测得密闭容器中各物质的浓度为c(CH4)=2.0mol·L-1、c(H2O)=4.0mol·L-1、c(CO2)=2.0mol·L-1、c(H)=2.0mol·L-1,则此时v正_____v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。

则下列热化学方程式不正确的是( )
A. 1/2A2(g)+1/2B2(g)=AB(g) ΔH=-91.5kJ·mol-1
B. A2(g)+B2(g)=2AB(g) ΔH=-183kJ·mol-1
C. 2AB(g)=A2(g)+B2(g) ΔH=+183kJ·mol-1
D. 1/2A2(g)+1/2B2=AB(g) ΔH=+91.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法不正确的是
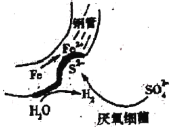
A.正极的电极反应式为:2H2O+2e-=H2+2OH-
B.SO42-与H2的反应可表示为:4H2+SO42- S2-+4H2O
S2-+4H2O
C.钢管腐蚀的直接产物中含有FeS、Fe(OH)3
D.在钢管表面镀锌可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
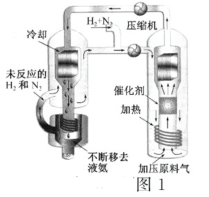
【题目】(一)合成氨工艺(流程如图1所示)是人工固氮最重要的途径。2018年是合成氨工业先驱哈伯(F·Haber)获得诺贝尔奖100周年。
N2和H2生成NH3的反应为:![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)△H(298K)=-46.2kJ·mol-1
NH3(g)△H(298K)=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)![]() 2H*
2H*
表面吸附:N*+H*![]() NH*;NH*+H*
NH*;NH*+H*![]() NH2*;NH2*+H*
NH2*;NH2*+H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)利于提高合成氨平衡产率的条件有_______________
A.低温B.高温C.低压D.高压E.催化剂
(2)标准平衡常数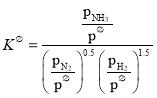 ,其中
,其中![]() 为标准压强1×105Pa,
为标准压强1×105Pa,![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() =
=![]() p,p为平衡总压,
p,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数
为平衡系统中NH3的物质的量分数
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为ω,则![]() =____________(用含ω的最简式表示)
=____________(用含ω的最简式表示)
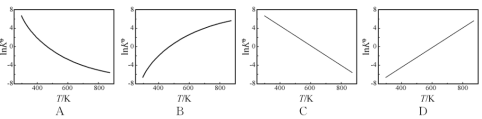
②图中可以示意标准平衡常数K随温度T变化趋势的是____________
(3)实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8
①分析说明原料气中N2过量的理由____________
②关于合成氨工艺的下列理解,正确的是____________
A.合成氨反应在不同温度下的△H和△S都小子零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
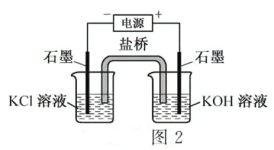
(二)高铁酸钾(K2FeO4)可用作水处理剂口某同学通过“化学一电解法”探究K2FeO4的合成,其原理如图2所示.接通电源,调节电压,将一定量C12通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4
(1)请写出“化学法”得到FeO42一的离子方程式____________
(2)请写出阳极的电极反应式(含FeO42-)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Persi等人以LiTi2O4作负极,LiFePO4作正极,采用LiClO4-EC-PC-PVdF凝胶作电解质溶液,组成新型锂离子二次电池,电池隔板只允许Li+通过,该锂离子二次电池的结构示意图如图,下列说法不正确的是
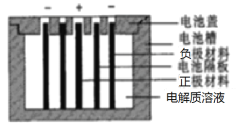
A.若正、负极材料质量相等,当外电路转移1 mol e-时,两极质量差为14g
B.放电时,LiFePO4电极的电势低于LiTi2O4的电势
C.放电时,电解质溶液中的Li+向LiFePO4一极移动
D.充电时,LiFePO4电极接电源的正极,发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com