
����Ŀ��Persi������LiTi2O4��������LiFePO4������������LiClO4��EC��PC��PVdF�������������Һ�������������Ӷ��ε�أ���ظ���ֻ����Li��ͨ����������Ӷ��ε�صĽṹʾ��ͼ��ͼ������˵������ȷ����
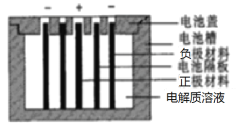
A.��������������������ȣ������·ת��1 mol e��ʱ������������Ϊ14g
B.�ŵ�ʱ��LiFePO4�缫�ĵ��Ƶ���LiTi2O4�ĵ���
C.�ŵ�ʱ���������Һ�е�Li����LiFePO4һ���ƶ�
D.���ʱ��LiFePO4�缫�ӵ�Դ������������������Ӧ
���𰸡�B
��������
�������֪��LiTi2O4��������LiFePO4��������ԭ��������ķ�Ӧ�ֱ��ǣ�
������Ӧ��![]() (
(![]() )
)
������Ӧ��Li(1��x)FePO4��![]() ��
��![]() = LiFePO4 (
= LiFePO4 (![]() )
)
A�����ݷ����������·ת��1 mol e��ʱ��������1 molLi��ΪLi�����������У��缫��������7g��������1 molLi����ΪLi�ڵ缫���������缫��������7g��������������Ϊ14g��A��ȷ��
B���ŵ�ʱΪԭ��أ�LiTi2O4��������LiFePO4�������������ĵ��Ƹߣ���LiFePO4�缫�ĵ��Ƹ���LiTi2O4�ĵ��ƣ�B����
C���ŵ�ʱ��������е��������������ƶ�������Li����LiFePO4һ���ƶ���C��ȷ��
D�����ʱ��ԭ��ص������ӵ�Դ��������Ϊ���ص�����������LiFePO4�缫�ӵ�Դ�����������ص���������������Ӧ��D��ȷ��
��ѡB��


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ɽ����ˮ�е��л������̿(AC)�ܴٽ�H2O2�ֽ�����ǻ����ɻ�(��OH)����߶�ˮ���л�������Ľ����ʡ�ʵ�������AC���������Ի�Ӱ��H2O2�ķֽⷴӦ��ʵ�����У���������AC�ڵ���(60mL��min-1)�Ͱ���(20mL��min-1)��������650���ȴ���2h���Ƶð������Ի���̿(ACN)���ش��������⣺
(1)����AC����AC��ĥ������10�������н���6h��ȥ�ҷ֣�������ˮϴ�������ԡ���ĥ��Ŀ����_____________��Ϊ�˷�ֹ���ù������ٴ���ˮ����ɺ��ACӦ����_________(����������)�б��á�
(2)�Ʊ�ACN��
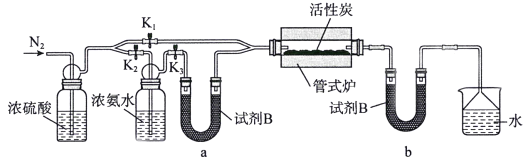
���װ�������Բ�����ҩƷ����ǰӦ���еIJ�����_________����Ŀ����_________��һ��ʱ���¯�����ȷ�Ӧ�ܣ���ʱ����K1��K2��K3��״̬Ϊ______________��U��b���Լ�B��������____________________��
(3)ͨ���������Դ����õ���ACN�������������Ȼ��ͷ��ǻ����京���ɲ��õζ����ⶨ���ⶨ�Ȼ������ķ���������ƿ�м���ACN 0.5g������0.05mol�� L-1��X��Һa mL���Ϻ���ҡ��������ƽ�⡣�Լ�����ָʾ������0.1mol��L-1�ı����ᷴ�ζ�ʣ���X��Һ���������ƽ������ΪbmL����XΪ________(�NaOH����Na2CO3����NaHCO3��)���������û���̿������Ȼ�����Ϊ______mol��kg-1(��֪��ACN�У��Ȼ���Ka=1.0��10-4�����ǻ���Ka=5.0��10-9��̼���Ka1=4.2��10-7��Ka2=5.6��10-11���ú�a��b�Ĵ���ʽ��ʾ)��
(4)ij��������2500mg��L-1������ҺΪģ�ͷ�ˮ���о�AC��ACN���������Զ�H2O2���ⱽ�ӵ�Ӱ�죬�õ�����ͼ��
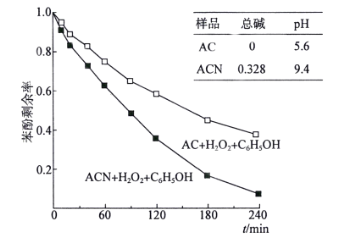
��ͼ���֪��________(�AC����ACN��)��������H2O2���ⱽ�ӣ�ԭ����__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦA2��B2 =2AB�������仯��ͼ��ʾ������˵����ȷ����( )
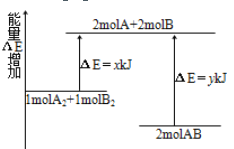
A. �÷�Ӧ�����ȷ�Ӧ
B. 2 mol A��B��������Ҫ����y kJ ������
C. 1 mol A��A����1mol B��B�������ܷų�x kJ������
D. 2 mol AB������������1 mol A2��1 mol B2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�CO��ˮ�����ֱ�Ϊ1 mol��3 mol�����ܱ������з�����ӦCO��H2O(g)![]() CO2��H2����ƽ�����CO2Ϊ0.75 mol����ͨ��6 molˮ�������ﵽ�µ�ƽ���CO2��H2�����ʵ���֮�Ϳ���Ϊ
CO2��H2����ƽ�����CO2Ϊ0.75 mol����ͨ��6 molˮ�������ﵽ�µ�ƽ���CO2��H2�����ʵ���֮�Ϳ���Ϊ
A. 1.2 mol B. 1.8 mol C. 2.5 mol D. 1.5mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����600 mLij�ֻ������Һ��ֻ���ܺ������������е������֣�K+��NH4+��Cl-��Mg2+��Ba2+��CO32-��SO42-���ֽ�����Һ�ֳ����ȷݣ���������ʵ�飺
��1�����һ���м���AgNO3��Һ���г���������
��2����ڶ����м�����NaOH��Һ�����Ⱥ��ռ�������0.04 mol��
��3����������м�����BaCl2��Һ�ø���ij���6.27g������������ϴ�ӡ������������Ϊ2.33g�� ��������ʵ�����������Ʋ���ȷ����
A. K+��һ������ B. Ba2+��Mg2+��һ��������
C. Cl-��һ������ D. �����Һ��CO32-��Ũ��Ϊ0.2 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȾԽ��Խ��Ϊ���ǹ�ע�����⣬�����е�NOx�����ѳ�(������)֮������ŷš�
��1��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺�� ��ӦCO(g)��H2O(g) ![]() H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯�����ʾ��
H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯�����ʾ��
�¶�/�� | 400 | 500 | 830 | 1 000 |
ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
�ٴ��ϱ������ƶϣ��˷�Ӧ��__________(����������������)�ȷ�Ӧ��
����830 ���£�����ʼʱ������ܱ������г���CO��H2O��Ϊ1 mol����ﵽƽ���CO��ת����Ϊ________��
��2��������β��ϵͳ��װ�ô�ת����������Ч����NOx��CO���ŷš�
��֪����2CO(g)��O2(g) ![]() 2CO2(g) ��H��566.0 kJ��mol1
2CO2(g) ��H��566.0 kJ��mol1
��N2(g)��O2(g) ![]() 2NO(g) ��H��+180.5 kJ��mol1
2NO(g) ��H��+180.5 kJ��mol1
��2NO(g)��O2(g) ![]() 2NO2(g) ��H��116.5 kJ��mol1
2NO2(g) ��H��116.5 kJ��mol1
�ش��������⣺
��CO��ȼ����Ϊ _________�� ��1 mol N2(g)��1 mol O2(g) �����л�ѧ������ʱ�ֱ���Ҫ����946 kJ��498 kJ����������1 mol NO(g) �����л�ѧ������ʱ�����յ�����Ϊ_________kJ��
��д��CO��NO2��ԭΪ���ʷ�Ӧ���Ȼ�ѧ����ʽΪ__________________________________________
��3�������������ϵĴ�ת����������������CO��NO2��ԭΪ���ʷ�Ӧ����һ���¶��£���һ������CO��NO2����2L�̶��ݻ��������У��ش��������⣺
�ٴӷ�Ӧ��ʼ��5min��������0.08mol N2����5min����(CO)=___________________molL1min1��
��25minʱ������Ũ�ȱ仯��ͼ��ʾ����ı������������___________(����ĸ���)��
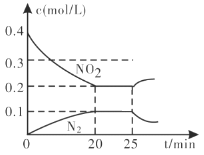
A.��С������� B.����NO2��Ũ�� C.�����¶� D.�����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2��g����2ICl��g��=I2��g����2HCl��g�����÷�Ӧ�֢١����������У�������������ͼ��ʾ�� ��֪��ICl����Ϊ��1�ۣ���Ϊ+1�ۡ������й�˵����ȷ����
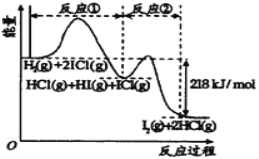
A.��Ӧ��Ϊ���ȷ�Ӧ
B.��Ӧ�ٺ͢ھ���ͬ��Ԫ�ؼ䷢����������ԭ��Ӧ
C.��Ӧ�ٱȷ�Ӧ�ڵ�������������Ӧ����Ӧ�Ļ���й�
D.HI��g����ICl��g�� ![]() I2��g����HCl��g�� ��H����218 kJ/mol
I2��g����HCl��g�� ��H����218 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪2P4+9KOH+3H2O�T3K3PO4+5PH3��Ӧ����������______�� �������뻹ԭ�����ʵ���֮����_________������������____________��
��2������˫���ŷ�������з�Ӧ����ת�Ƶķ������Ŀ10Al+6NaNO3 +4NaOH�T10NaAlO2 +3N2��+2H2O______________________
��3��Mn2+��Bi3+��BiO3����MnO4����H+��H2O��ɵ�һ��������ԭϵͳ�У�����BiO3����Bi3+�ķ�Ӧ���̣��ݴ˻ش��������� ����������ԭ��Ӧ�У�����ԭ��Ԫ����____________��
���뽫����������ԭ���Ļ�ѧʽ����ƽ��ķ���ʽ����������Ӧ��λ���У����õ����ŷ��������ת�Ƶķ������Ŀ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����ö���������Ũ�����Ʊ�������ʵ��װ�ã�������ͼ��գ�
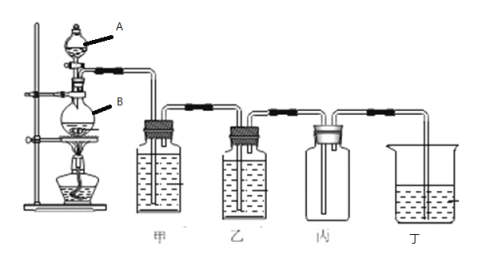
��1������A�����ƽ�_______������B�����ƽ�_______��
��2��д���ö���������Ũ�����Ʊ����������ӷ���ʽ______��
��3������ʢ��______��������_______��
��4������ʢ��______��������_____��
��5������������____��ʵ����ɺ���е�������________��
��6��������ʢ��NaOH��Һ��д��������Ӧ�����ӷ���ʽ��_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com