
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 kJ·mol1
2NO(g) ΔH=+180.5 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。 若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为__________________________________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___________________molL1min1。
②25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
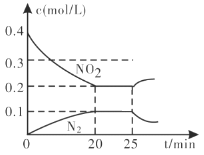
A.缩小容器体积 B.增加NO2的浓度 C.降低温度 D.升高温度
【答案】放 50% 283kJ/mol 631.75 2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH = -1196kJ/mol 0.032 D
【解析】
(1)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K为![]() ,由表格中的数据可知,温度越大,K越小,则正反应为放热反应;
,由表格中的数据可知,温度越大,K越小,则正反应为放热反应;
②830℃, CO(g)+H2O(g)H2(g)+CO2(g),
开始(mol) 1 1 0 0
转化(mol) x x x x
平衡(mol) 1-x 1-x x x
设容器的体积为VL,K=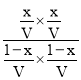 =1,解得x=0.5,则CO的转化率为
=1,解得x=0.5,则CO的转化率为![]() ×100%=50%;
×100%=50%;
(2)①由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热为283kJ/mol;
2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热为283kJ/mol;
若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1 mol NO(g) 分子中化学键断裂时需吸收的能量为y,由②N2(g)+O2(g) ![]() 2NO(g) ΔH=946kJ /mol+498kJ/mol -2y=+180.5kJ/mol,解之得y=631.75kJ/mol,所以1 mol NO(g) 分子中化学键断裂时需吸收的能量为631.75kJ;
2NO(g) ΔH=946kJ /mol+498kJ/mol -2y=+180.5kJ/mol,解之得y=631.75kJ/mol,所以1 mol NO(g) 分子中化学键断裂时需吸收的能量为631.75kJ;
②由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1,②N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ·mol1,②N2(g)+O2(g) ![]() 2NO(g) ΔH==+180.5kJ/mol,③2NO(g)+O2(g)
2NO(g) ΔH==+180.5kJ/mol,③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1,①×2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(566.0 kJ·mol1)×2-(+180.5kJ/mol)-( 116.5 k J·mol1)=-1196kJ/mol,所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol;
2NO2(g) ΔH=116.5 kJ·mol1,①×2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(566.0 kJ·mol1)×2-(+180.5kJ/mol)-( 116.5 k J·mol1)=-1196kJ/mol,所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol;
(3)①2NO2(g)+4CO(g)=N2(g)+4CO2(g),从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=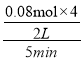 =0.032molL1min1;
=0.032molL1min1;
②由图像可知,25min时,改变条件的瞬间NO2和N2的浓度都不变,改变条件后,NO2浓度增大,N2浓度减小,说明平衡逆向移动,故改变的条件应该是升高温度;答案选D。


科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法不正确的是
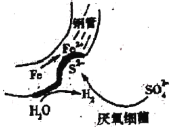
A.正极的电极反应式为:2H2O+2e-=H2+2OH-
B.SO42-与H2的反应可表示为:4H2+SO42- S2-+4H2O
S2-+4H2O
C.钢管腐蚀的直接产物中含有FeS、Fe(OH)3
D.在钢管表面镀锌可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
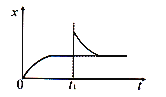
A. υ逆(逆反应速率)B. ρ(容器内气体密度)
C. m(容器内CaO质量)D. p(容器压强)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Persi等人以LiTi2O4作负极,LiFePO4作正极,采用LiClO4-EC-PC-PVdF凝胶作电解质溶液,组成新型锂离子二次电池,电池隔板只允许Li+通过,该锂离子二次电池的结构示意图如图,下列说法不正确的是
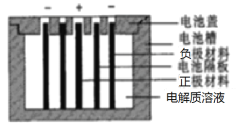
A.若正、负极材料质量相等,当外电路转移1 mol e-时,两极质量差为14g
B.放电时,LiFePO4电极的电势低于LiTi2O4的电势
C.放电时,电解质溶液中的Li+向LiFePO4一极移动
D.充电时,LiFePO4电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
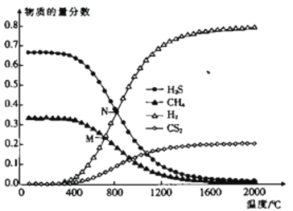
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池比传统电池有更长的循环寿命和功率密度,其工作原理如图所示。下列有关该电池的说法正确的是
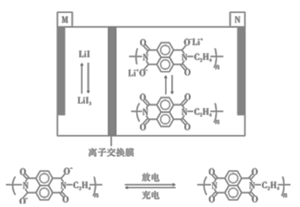
A.充电时N电极上发生氧化反应
B.放电时M极的电极反应式为3I--2e-=I3-
C.充电时Li+通过离子交换膜从M池进入N池
D.放电时每当有2 mole-转移时生成1 mol 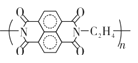
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com