
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
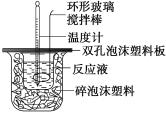
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
【答案】减少热量损失 不能 铁会和盐酸反应;铁导热性好,热量损失较大 为了确保盐酸完全被中和 不相等 相等 NaOH(aq)+HCl(aq)= NaCl(aq)+ H2O (l) ΔH=-57.3 kJ/mol C abcd
【解析】
(1)中和热测定实验成败的关键是保温工作;
(2)铁是热的良导体,易传热,且铁能与盐酸反应;
(3)氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,结合中和热的概念和实质来回答;
(4)根据稀强酸与稀强碱中和生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(5)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(6)从对热量的影响分析即可。
(1)中和热测定实验成败的关键是保温工作,烧杯间填满碎泡沫塑料的作用是:减少实验过程中的热量损失;
(2)铁是热的良导体,易传热,热量散失较大,实验测得误差较大,且铁能与盐酸反应;
(3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增多,但是中和热是以强酸和强碱反应生成1mol水时放出的热为标准,与酸碱的用量无关;
(4)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,盐酸和氢氧化钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O (l)△H=-57.3 kJ/mol;
(5)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故答案为C;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a符合题意;
b.温度计测定NaOH溶液起始温度后直接插入稀HCl测温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故b符合题意;
c.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小,中和热的数值偏小,故c符合题意;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小,故d符合题意;
故答案为:abcd。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:甲醛结构式为:![]() ,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
6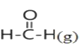 +4NH3(g)→
+4NH3(g)→ +6H2O(l)
+6H2O(l)
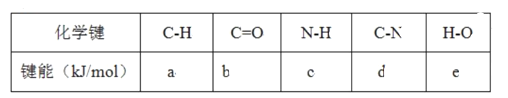
A. 6(a+b+c-d-e) kJ·mol-1B. 6(d+e-a-b-c) kJ·mol-1
C. 6(b+2c-2d-2e) kJ·mol-1D. 6(2d+2a+2e-b-3c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题:
(1)炒过菜的铁锅未及时洗浄(残液中含NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:铁锅的锈蚀应属于____________(填“析氢腐蚀”或“吸氧腐蚀”), 铁锅锈蚀的正极反应式为:____________。
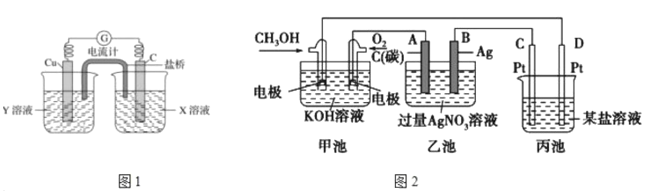
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如上图1所示原电池,回答下列问题:
①写出正极电极反应式___________
②图中X溶液中的溶质是____________
(3)如图2是一个电化学反应的示意图。
①写出通入CH3OH的电极的电极反应式_______________
②乙池中总反应的离子方程式_____________
③熔融盐CH3OH燃料电池用熔融碳酸钾为电解质,则电池负极反应式__________
④当乙池中B(Ag)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液H+的浓度是_____________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_____(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含铁废铜制备胆矾的流程如下图所示:
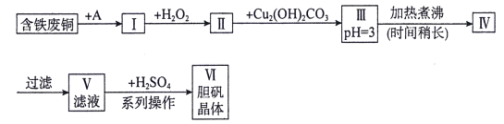
下列说法错误的是( )
A.物质A可选用盐酸
B.I中加H2O2的目的是溶解铜并将Fe2+氧化为Fe3+
C.长时间煮沸Ⅲ中悬浊液的目的是充分聚沉Fe(OH)3
D.“系列操作”包括蒸发浓缩,冷却结晶,过滤,洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
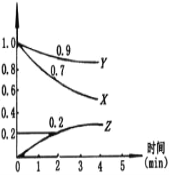
(1)由图中数据该反应的化学方程式为_________________。
(2)反应开始至2min,用Z表示的平均反应速率为________。用X表示的平均反应速率为___________________
II 对于可逆反应CO(g)+H2O (g) ![]() CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
①恒温恒压时,向容器中充入0.5mol的He,这时反应速率___________(填“加快”、“减慢”或 “不变”),原因是____________________
②恒温恒容时,加入0.3mol的CO,这时反应速率___________(填“加快”、“减慢”或 “不变”),原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是( )
A.已知2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
B.由C(石墨,s)![]() C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C.同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件的ΔH不同
2HCl(g)在光照和点燃条件的ΔH不同
D.化学变化不一定都伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O。下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1molFe3O4,转移电子的物质的量为2mol
D.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2可降解废水中的有机物,活性炭(AC)能促进H2O2分解产生羟基自由基(·OH),提高对水中有机化合物的降解率。实验表明,AC表面的酸碱性会影响H2O2的分解反应。实验室中,将纯化的AC在氮气(60mL·min-1)和氨气(20mL·min-1)气氛中于650℃热处理2h可制得氨气改性活性炭(ACN)。回答下列问题:
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6h除去灰分,用蒸馏水洗涤至中性。研磨的目的是_____________。为了防止放置过程中再次吸水,烘干后的AC应置于_________(填仪器名称)中备用。
(2)制备ACN:
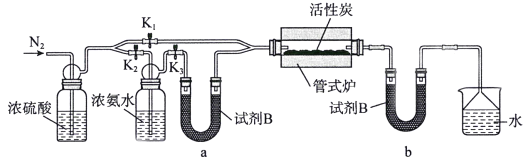
检查装置气密性并加入药品后,加热前应进行的操作是_________,其目的是_________;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为______________。U型管b内试剂B的作用是____________________。
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入ACN 0.5g,加入0.05mol· L-1的X溶液a mL。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1mol·L-1的标准盐酸反滴定剩余的X溶液,标准盐酸的平均用量为bmL。则X为________(填“NaOH”“Na2CO3”或“NaHCO3”),计算所得活性炭表面的羧基含量为______mol·kg-1(已知:ACN中,羧基的Ka=1.0×10-4、酚羟基的Ka=5.0×10-9、碳酸的Ka1=4.2×10-7、Ka2=5.6×10-11;用含a、b的代数式表示)。
(4)某课题组以2500mg·L-1苯酚溶液为模型废水,研究AC和ACN表面的酸碱性对H2O2降解苯酚的影响,得到如下图像:
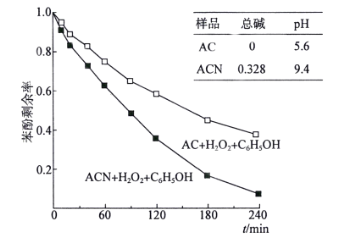
由图像可知,________(填“AC”或“ACN”)更有利于H2O2降解苯酚,原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 =2AB的能量变化如图所示。下列说法正确的是( )
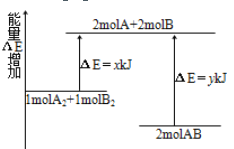
A. 该反应是吸热反应
B. 2 mol A—B键断裂需要吸收y kJ 的能量
C. 1 mol A—A键和1mol B—B键断裂能放出x kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com