
【题目】关于氨的下列叙述中,不正确的是( )
A.液氨是纯净物
B.NH3的催化氧化可用于制取硝酸
C.氨易液化,因此可用来作制冷剂
D.实验室常用湿润的蓝色石蕊试纸检验氨气
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于平衡常数的说法正确的是( )
A. 在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度
B. 在任何条件下,化学平衡常数是一个恒定值
C. 平衡常数的大小与温度、浓度、压强、催化剂等无关
D. 从平衡常数的大小可以推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)B、C的结构简式分别为________、________。
(2)写出反应①、③、④的化学方程式:
①______________________________________________________________。
④______________________________________________________________。
③______________________________________________________________。
(3)反应①、③、④、⑤的反应类型分别为①______,③______,④_____,⑤_____。
(4)A中官能团的名称是___________,检验这种官能团除了可以用银氨溶液还可以用______________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态原子的核外电子排布式为[Ar]3d104s1的元素在元素周期表中的位置是
A.p 区、第四周期第ⅠB 族B.ds 区、第四周期第Ⅷ族
C.d 区、第四周期第ⅠB 族D.ds 区、第四周期第ⅠB 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列数值一定变小的是
A. c(H+) B. c (H+) /c(CH3COOH)
C. c (H+)·c(OH-) D. c(OH-)/c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,其性质活泼,具有强还原性,是常用的食品抗氧化剂之一。制备该物质的反应方程式为: Na2SO3+SO2= Na2S2O5,某研究小组利用该反应在实验室制备焦亚硫酸钠并探究其有关性质。请回答下列问题:
(1)采用下图装置制取Na2S2O5,装置Ⅲ中有Na2S2O5晶体析出。
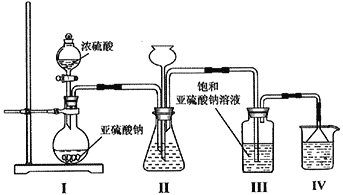
①装置Ⅰ中盛放浓硫酸的仪器名称为__________;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是___________________________________。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择____________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是_______________;裝置Ⅳ的作用是_________________________,盛装的试剂为_____________________。
(2)将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。
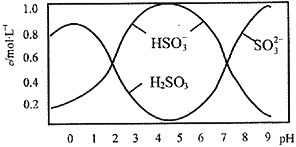
①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式_____________________;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因_____________________________。
(3)检验Na2S2O5晶体在空气中已被氧化的实验方案是_________________________。
(4)葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:
![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为___g·L-1,该数据说明某葡萄酒中SO2的残留量_________ (填“是”或“否”)达到我国国家标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 molL-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH 固体,lg![]() 随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
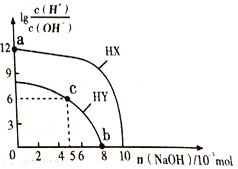
A. HX的酸性弱于HY
B. c点溶液中c(Y-)<c(HY)
C. a点由水电离出的c(H+)=10-12 molL-1
D. b点溶液中离子浓度大小关系为c(Y-)+c(HY)=c(Na+)+0.02 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com