
【题目】常温下,向浓度均为0.1 molL-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH 固体,lg![]() 随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
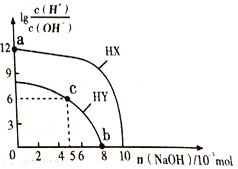
A. HX的酸性弱于HY
B. c点溶液中c(Y-)<c(HY)
C. a点由水电离出的c(H+)=10-12 molL-1
D. b点溶液中离子浓度大小关系为c(Y-)+c(HY)=c(Na+)+0.02 molL-1
【答案】D
【解析】A.lg![]() 越大,溶液中氢离子浓度越大,未加NaOH时,HX溶液中lg
越大,溶液中氢离子浓度越大,未加NaOH时,HX溶液中lg![]() 的值大,所以HX的酸性大于HY,故A错误;B.c点lg
的值大,所以HX的酸性大于HY,故A错误;B.c点lg![]() =6,则溶液中c(H+)=10-4mol/L,此时消耗的NaOH为0.005mol,则溶液中的溶质为NaY和HY,由于溶液显酸性,所以HY的电离程度大于NaY的水解程度,所以c(Y-)>c(HY),故B错误;C.a点lg
=6,则溶液中c(H+)=10-4mol/L,此时消耗的NaOH为0.005mol,则溶液中的溶质为NaY和HY,由于溶液显酸性,所以HY的电离程度大于NaY的水解程度,所以c(Y-)>c(HY),故B错误;C.a点lg![]() =12,则溶液中c(H+)=0.1mol/L,溶液中水电离的c(H+)=
=12,则溶液中c(H+)=0.1mol/L,溶液中水电离的c(H+)=![]() =10-13molL-1,故C错误; D.b点lg
=10-13molL-1,故C错误; D.b点lg![]() =0,则溶液中c(H+)= c(OH-)=10-7mol/L,此时消耗的NaOH为0.008mol,c(Na+)=0.08 mol/L,根据物料守恒,c(Y-)+c(HY)=0.1 mol/L,因此c(Y-)+c(HY)=c(Na+)+0.02 molL-1,故D正确;故选D。
=0,则溶液中c(H+)= c(OH-)=10-7mol/L,此时消耗的NaOH为0.008mol,c(Na+)=0.08 mol/L,根据物料守恒,c(Y-)+c(HY)=0.1 mol/L,因此c(Y-)+c(HY)=c(Na+)+0.02 molL-1,故D正确;故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种抗病毒药物,在实验室中利用芳香烃A制备H的流程如下图所示(部分反应条件已略去):
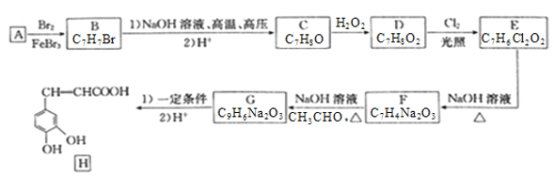
己知:①有机物B苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③![]() ;
;
④ 。
。
(1)有机物B的名称为___________________。
(2)由D生成E的反应类型为__________________,E中官能团的名称为__________________。
(3)由G生成H所需的“一定条件”为____________________。
(4)写出B与NaOH溶液在高温高压下反应的化学方程式:___________________________。
(5)F酸化后可得K,X是K的同分异构体,X能发生银镜反应,且其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为1:1:1,写出2种符合条件的X的结构简式:___________________。
(6)设计由![]() 和丙醛合成
和丙醛合成![]() 的流程图:_______________________ (其他试剂任选)。
的流程图:_______________________ (其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的下列叙述中,不正确的是( )
A.液氨是纯净物
B.NH3的催化氧化可用于制取硝酸
C.氨易液化,因此可用来作制冷剂
D.实验室常用湿润的蓝色石蕊试纸检验氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见实验仪器或装置。请回答下列问题
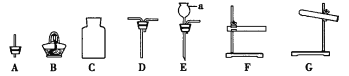
(1)仪器a的名称是__________。
(2)利用高锰酸钾制取并收集O2应选仪器__________(填序号),发生反应的化学方程式为__________。装入药品后,应__________,再塞上橡皮塞,收集氧气时,气体应从D的__________端通入。
(3)用CO还原Fe2O3并检验生成的气体产物,应选仪器__________(填序号);加热前应__________,目的是__________,然后用酒精灯预热,再对准固体加热。处理尾气的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需的微量元素,在医药和工业中都有广泛用途,因此从含碘废液中回收碘充分利用二次资源是非常重要的。实验室从含碘废液(除H2O外,含有CCl4、I2、I-)中回收碘,其实验过程如图1:(己知氧化性Cl2> IO3-)
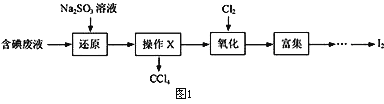
(1)向含碘废液中加入稍过量的Na2SO3溶液,反应的离子方程式为_________,该操作将I2还原为I-的目的是_________________________________________;
(2)操作X的名称为______________________________________;
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,通入Cl2,在40℃左右反应(实验装置如图2所示)。下列有关说法正确的是_____(填字母)。
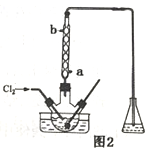
a.在实验中要缓慢通入氯气。提高氯气的利用率,防止产生污染
b.控制在较低温度下进行的主要原因是增大氯气的溶解度
c.通入过量的氯气可提高碘的产量
d.为有效防止碘的挥发水应从b口通入
e.锥形瓶中应盛放NaOH溶液
(4)二氧化氯(C1O2,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用C1O2氧化酸性含I-废液回收碘。
①写出C1O2氧化I-的离子方程式____________________________________。
②若处理含I-相同量的废液回收碘、所需Cl2的物质的量是C1O2的______________倍。
(5)已知:5SO32-+2IO3-+2H+![]() I2+5SO42-+H2O。某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
I2+5SO42-+H2O。某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
①取适量含碘废水用CCl4多次萃取、分液,直到水层检验不出碘单质存在;
②_______________________;
③另从水层取少量溶液,加入2-3滴淀粉溶液,滴加________________(填试剂和现象)。说明废水中含有IO3-,否则说明废水中不含IO3-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al ④Al(OH)3 ⑤MgO ⑥(NH4)2CO3
A.①②③④⑥B.②③④⑤C.①②③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________________ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() )________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
)________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是__________(填写字母),导致pH随温度变化的原因是___________________________________________;
②20℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )c(
)c(![]() )3c(Al3+)=_________(填数值)。
)3c(Al3+)=_________(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com