
【题目】焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,其性质活泼,具有强还原性,是常用的食品抗氧化剂之一。制备该物质的反应方程式为: Na2SO3+SO2= Na2S2O5,某研究小组利用该反应在实验室制备焦亚硫酸钠并探究其有关性质。请回答下列问题:
(1)采用下图装置制取Na2S2O5,装置Ⅲ中有Na2S2O5晶体析出。
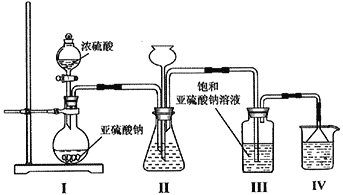
①装置Ⅰ中盛放浓硫酸的仪器名称为__________;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是___________________________________。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择____________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是_______________;裝置Ⅳ的作用是_________________________,盛装的试剂为_____________________。
(2)将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。
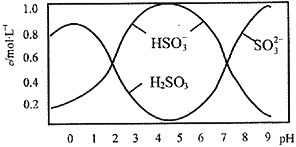
①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式_____________________;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因_____________________________。
(3)检验Na2S2O5晶体在空气中已被氧化的实验方案是_________________________。
(4)葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:
![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为___g·L-1,该数据说明某葡萄酒中SO2的残留量_________ (填“是”或“否”)达到我国国家标准。
【答案】 分液漏斗 防止产品被空气中的氧气氧化 c 过滤 处理尾气,防止空气污染 NaOH 溶液 Na2S2O5+H2O=2NaHSO3 溶液中HSO3-的电离程度大于其水解程度 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 0.128 是
【解析】(1)①装置Ⅰ中盛放浓硫酸的仪器名称为分液漏斗;因焦亚硫酸钠具有强还原性,防止其产品被空气中的氧气氧化,故滴加浓硫酸前需要将装置內的空气排净;②装置Ⅱ的作用之一是观察SO2的生成速率,即所选择的液体不能与二氧化硫反应,最好选择c;③装置Ⅲ中饱和亚硫酸钠溶液与二氧化硫反应生成焦亚硫酸钠晶体,故分离出Na2S2O5晶体可采取的操作方法是过滤;裝置Ⅳ的作用是吸收多余的二氧化硫,防止污染环境,故应盛装NaOH溶液;(2)①Na2S2O5溶于水,测得该溶液pH=4.5,根据图像可知,溶液中主要微粒为HSO3—,即:Na2S2O5+H2O=2NaHSO3;②因溶液中HSO3-既能电离,又能水解,其电离程度大于其水解程度,导致溶液显酸性;(3)若Na2S2O5晶体在空气中已被氧化,则应该生成Na2SO4,通过检验样品中是否含有SO42-,即取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成,证明Na2S2O5晶体在空气中已被氧化;(4)根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量
=![]() =0.128g/L;该数据说明某葡萄酒中SO2的残留量是达到我国国家标准。
=0.128g/L;该数据说明某葡萄酒中SO2的残留量是达到我国国家标准。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程:

(1)操作①中必须用到的一种仪器是______(填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是_________。
(3)实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是______(填序号)。
A.粗盐没有全部溶解即过滤 B.蒸发时液滴飞溅剧烈
C.蒸发后所得“精盐”很潮湿 D.蒸发皿上粘有的“精盐”没有全部转移到称量纸上
(4)小明查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中操作⑤得到的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种)。

①提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、KOH溶液、饱和NaCl溶液。从提供的试剂中选出a所代表的试剂是___________、___________。
②在滤液中加盐酸的作用是_____________、____________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。下列关于该装置的说法错误的是
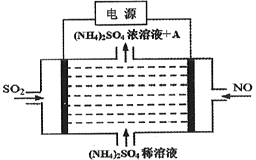
A. SO2通入阳极,该电极上发生氧化反应
B. 物质A为硫酸
C. 阴极的电极反应为: NO-5e-+6H+=NH4++H2O
D. (NH4)2SO4可作为肥料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp[AgCl]=1.8×10-10,Ksp[AgBr]=4.9× 10-13,Ksp[AgI]=1.0×10-16,Ksp[Ag2S]=1.6×10-49。则除去NaNO3溶液中混有的AgNO3,所用下列试剂中效果最好的是
A. NaC1溶液 B. NaBr 溶液 C. NaI溶液 D. Na2S溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的下列叙述中,不正确的是( )
A.液氨是纯净物
B.NH3的催化氧化可用于制取硝酸
C.氨易液化,因此可用来作制冷剂
D.实验室常用湿润的蓝色石蕊试纸检验氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法,如图所示的两个装置都可以制取蒸馏水。

(1)图Ⅰ是实验室制取蒸馏水的常用装置,仪器A、B、C的名称分别是_________、________、_______。加热A时要加垫石棉网,目的是_________________________________。
(2)图Ⅰ中冷凝水的流向是否正确?____(填“正确”或“不正确”),理由是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量____,其作用是____________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图Ⅰ完全相同。该装置中使用的玻璃导管较长,其作用是_______________;烧杯中还应盛有的物质是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需的微量元素,在医药和工业中都有广泛用途,因此从含碘废液中回收碘充分利用二次资源是非常重要的。实验室从含碘废液(除H2O外,含有CCl4、I2、I-)中回收碘,其实验过程如图1:(己知氧化性Cl2> IO3-)
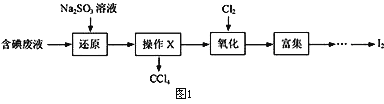
(1)向含碘废液中加入稍过量的Na2SO3溶液,反应的离子方程式为_________,该操作将I2还原为I-的目的是_________________________________________;
(2)操作X的名称为______________________________________;
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,通入Cl2,在40℃左右反应(实验装置如图2所示)。下列有关说法正确的是_____(填字母)。
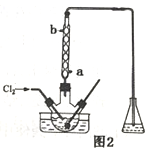
a.在实验中要缓慢通入氯气。提高氯气的利用率,防止产生污染
b.控制在较低温度下进行的主要原因是增大氯气的溶解度
c.通入过量的氯气可提高碘的产量
d.为有效防止碘的挥发水应从b口通入
e.锥形瓶中应盛放NaOH溶液
(4)二氧化氯(C1O2,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用C1O2氧化酸性含I-废液回收碘。
①写出C1O2氧化I-的离子方程式____________________________________。
②若处理含I-相同量的废液回收碘、所需Cl2的物质的量是C1O2的______________倍。
(5)已知:5SO32-+2IO3-+2H+![]() I2+5SO42-+H2O。某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
I2+5SO42-+H2O。某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
①取适量含碘废水用CCl4多次萃取、分液,直到水层检验不出碘单质存在;
②_______________________;
③另从水层取少量溶液,加入2-3滴淀粉溶液,滴加________________(填试剂和现象)。说明废水中含有IO3-,否则说明废水中不含IO3-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com